عملکرد فیتازهای مختلف از لوله آزمایش تا لوله گوارش
คาสิโนออนไลน์ ประเทศไทย
2020/06/19
پروتکل پیشنهادی ضد عفونی فارم
2020/06/28عملکرد فیتازهای مختلف از لوله آزمایش تا لوله گوارش
((شناخت معیارهای اساسی برای انتخاب فیتاز موثر در جیره طیور))
Understanding the basic criteria for choosing an effective Phytase in poultry diets
(Dr. Fakhreddin Abed (PHD of Animal Nutrition
دکتر فخرالدین عابد (متخصص تغذیه دام و طیور)
مدیر مارکتینگ و علمی شرکت تولیدی بازرگانی لعل حیات وسام
مقدمه و طرح مشکل:
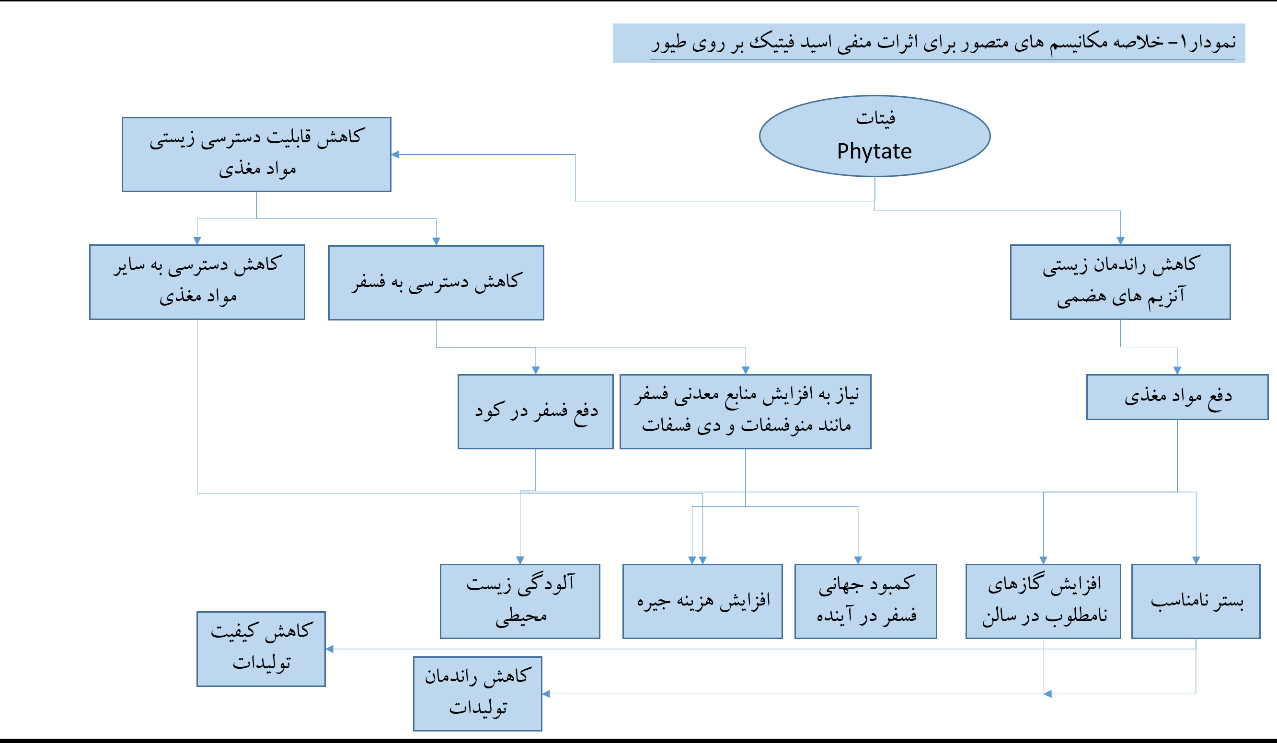
ترکیب جیره های طیور به طور عمده از اقلام خوراکی گیاهی تشکیل شده است. قابلیت دسترسی زیستی مواد مغذی جیره های طیور می تواند تحت تاثیر عوامل متعددی از جمله میزان مواد ضد تغذیه ای و کمپلکس های غیر قابل هضم موجود در آنها قرار بگیرد. یکی از این مواد ضد تغذیه ای فیتات ها می باشند. به طور معمول قسمت اعظم فسفر اقلام خوراکی گیاهی (حدود ۶۰ تا ۸۰%)، به صورت فیتاته می باشد که برای پرنده غیر قابل دسترس می باشد [۱].
فیتات چیست؟
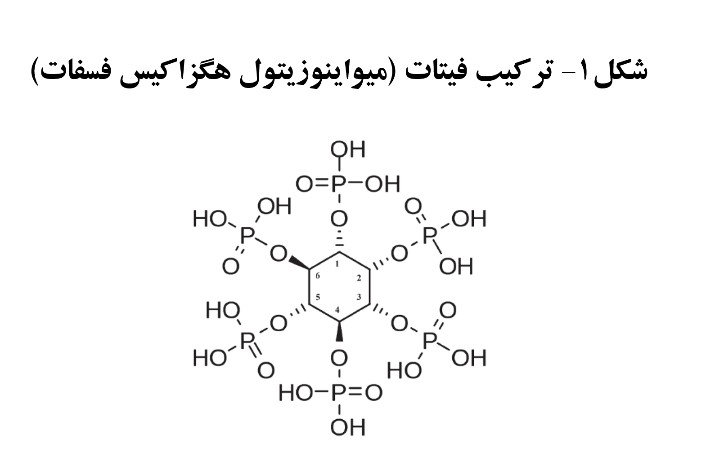
فیتات از یک حلقه میواینوزیتول ساخته شده است که در یک سری پیوند استری با ۶ عدد فسفر قرار گرفته اند (شکل۱). برای کنترل ذخیره فسفر در دانه گیاه، این اشکال به وجود می آیند و در طی مراحل جوانه زنی دانه، با آزاد سازی فیتاز در دانه، مجددا در دسترس گیاه قرار می گیرند [۲, ۳]. فرم نمکی اسید فیتیک، در اطلاح فیتات خوانده می شود و اغلب هم، اشکال اسید فیتیک به صورت نمک حضور دارند (فیتین). این اشکال از فسفر، برای پرنده دسترسی بسیار پایینی دارند. وجود این ترکیب به عنوان یک ماده ضد تغذیه ای منحصر به محدود کردن قابلیت دسترسی زیستی فسفر نیست بلکه قابلیت هضم سایر مواد مغذی از جمله پروتئین، عناصر معدنی، نشاسته و چربی را تحت تاثیر منفی قرار می دهد [۳].
راهکار حل مشکل:
مبحث استفاده از آنزیم ها به ویژه آنزیم های فیتاز در جیره طیور یکی از مباحث مورد توجه متخصصین تغذیه می باشد و نتایج آزمایشات علمی جدیدتر جنبه های مبهم را در این زمینه روشن تر نموده است [۳]. آنزیم فیتاز از زیر گروه آنزیم های فسفاتازها هست توانایی دفسفریلاسیون (جدا کردن فسفر از مولکول اینوزیتول هگافسفات) را داراست [۱]. فیتازهای مختلفی در بخش تجاری به صنعت پرورش طیور معرفی شدهاند که همگی ادعای بهترین و موثرترین را به دوش می کشند و متخصصین جیره نویسی در اقیانویسی از اطلاعات، داده ها و ادعاهای شرکت های تولید کننده و فروشنده غرق شده اند.
انواع مختلف فیتاز و نحو ه عملکرد آنها:
اولین و گستردهترین گروه فیتازهایی که مورد مطالعه قرار گرفتهاند، فسفاتازهای اسید هیستیدین (HAPs) میباشند. کلاسهای دیگر فیتازها، بتاپروپیلر فیتازها [۱] (BPPhy )، که به آنها فیتازهای قلیایی نیز گفته می شود، فیتاز اسید بنفش [۲] و پروتئین تیروزین فسفاتاز [۳] نیز از کلاس های دیگر می باشند. در حال حاضر فیتازهای تجاری در صنعت پرورش طیور همگی متعلق به اسیدهیستیدین ها و فسفاتازهای اسیدی هستند.
۱- منشا فیتازها
اولین نسل فیتازهای تجاری از یک فیتاز قارچی (آسپرژیلوس نایجر [۴]) منشا شده بودند. در سال ۱۹۹۹، فیتاز با منشاء اشرشیاکلی به بازار معرفی شد که موثرتر از فیتازهای نسل اول بود. همچنین فیتازها بر اساس موقعیت هیدرولیز اولین فسفر از حلقه کربنی میواینوزیتول نیز تقسیم بندی می شوند مانند ۳- فیتاز و ۶- فیتاز.
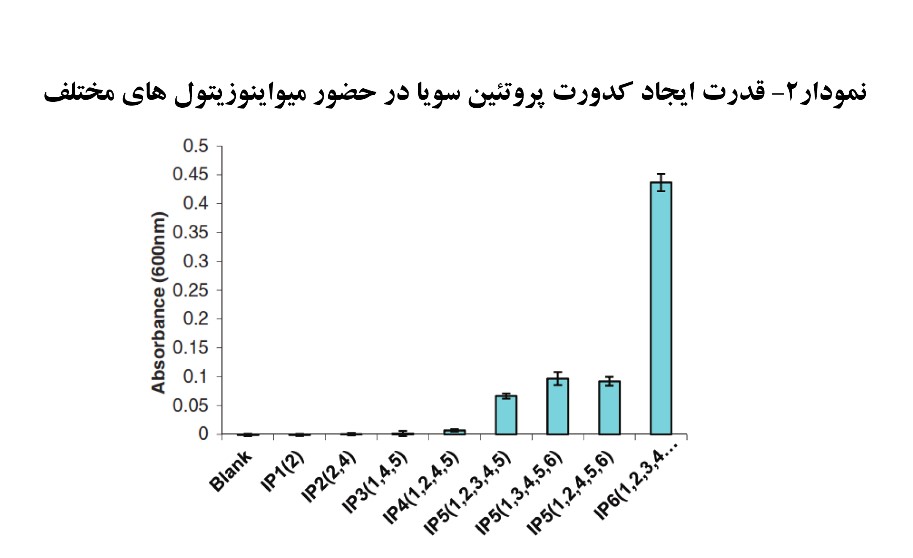
فیتازهای تجاری در pH بهینه فعالیت خود، مقاومت در برابر پروتئاز درونزادی (مانند پپسین) و میزان تمایل به اتصال به سوبسترای فیتات تأثیر می گذارند، که ممکن است مهمترین فاکتورها در تأثیرگذاری آنها در شرایط مجرای گوارش پرنده باشد. همچنین مشاهده شده است که فیتازهای باکتریایی نسل جدید خاصیت IP6 و IP5 را دارند و مقاومت بالاتری نسبت به هضم پروتئازهایی مانند پپسین نسبت به فیتازهای قارچی دارند. نحوه عمل فیتازها به صورت مرحله ای است. بدین معنا که ابتدا یک فسفر از حلقه میواینویتول هگزاکیس فسفات جدا شده و تبدیل به پنتا – استر می شود و سپس به تترا-استر و به همین ترتیب تا انتها. این مفهوم یعنی این که در شرایط ایده آل تا زمانی همه ی سوبستراهای موجود از هگزا – استر به پنتا – استر تبدیل نشوند، مرحله بعدی که تبدیل به تترا – استر است آغاز نمی شود [۴]. دانستن این مورد به نحوه سنجش عملکرد فیتازها در آزمایشگاه کمک شایانی نموده است زیرا با اندازه گیری این ترکیبات حد واسط می توان میزان عملکرد و سرعت فیتازهای مختلف را مورد ارزیابی قرار داد. از روش کدورت سنجی میزان محلولیت پروتئین های سویا را در حضور فیتات ارزیابی می نمایند که در صورت اتصال پروتئین ها به فیتات میزان کدورت افزایش می یابد. همان طور که در نمودار ۲ مشاهده می گردد، قدرت میواینوزیتول هگزاکیس فسفات (IP6) برای جذب پروتئین ها بسیار بالاتر از سایر میواینوزیتول ها می باشد در حالی که قدرت اتصال به پروتئین میواینوزیتول های ۱ تا ۴ بسیار پایین است. در چنین آزمایشاتی نشان داده شد که قدرت اتصال به پروتئین فیتاتهایی که در معرض فیتاز با منشا اشرشیاکلی(باکتریایی) بودند نسبت به در معرض قرار گیری با فیتاز آسپرژیلوس نایجر (فیتاز قارچی) پایین تر بود.
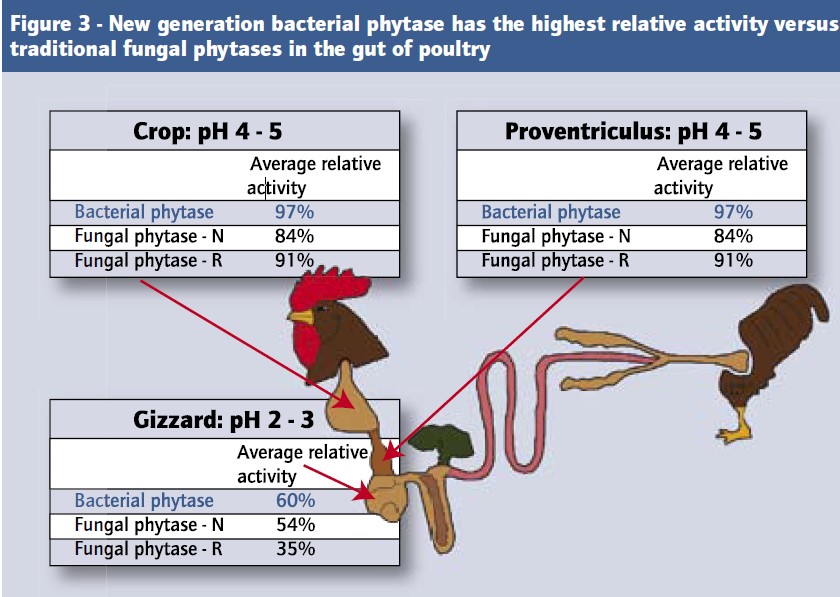
۲- pH بهینه برای عملکرد زیستی:
نتایج آزمایشات نشان داده که بیشترین میزان اتصال فیتات به پروتئین ها و مواد معدنی مانند کلسیم در قسمت های اسیدی مجرای گوارشی (ابتدای مجرای گوارشی تا قبل از دوازدهه) اتفاق می افتد، یکی از معیارهای انتخاب فیتاز موثر، عملکرد مناسب فیتاز در شرایط اسیدی می باشد [۳]. فعالیت فیتاز به صورت استاندارد بدین صورت تعریف می شود که ۱ واحد مقدار فیتاز ۱ میلی مول فسفات معدنی را در یک دقیقه از ۰/۰۰۵۱ میلی مول بر لیتر فیتات سدیم در pH 5.5 و در دمای ۳۷ درجه آزاد می کند. بیان واحد فیتاز به صورت FTU یاFYT و یا U می باشد.
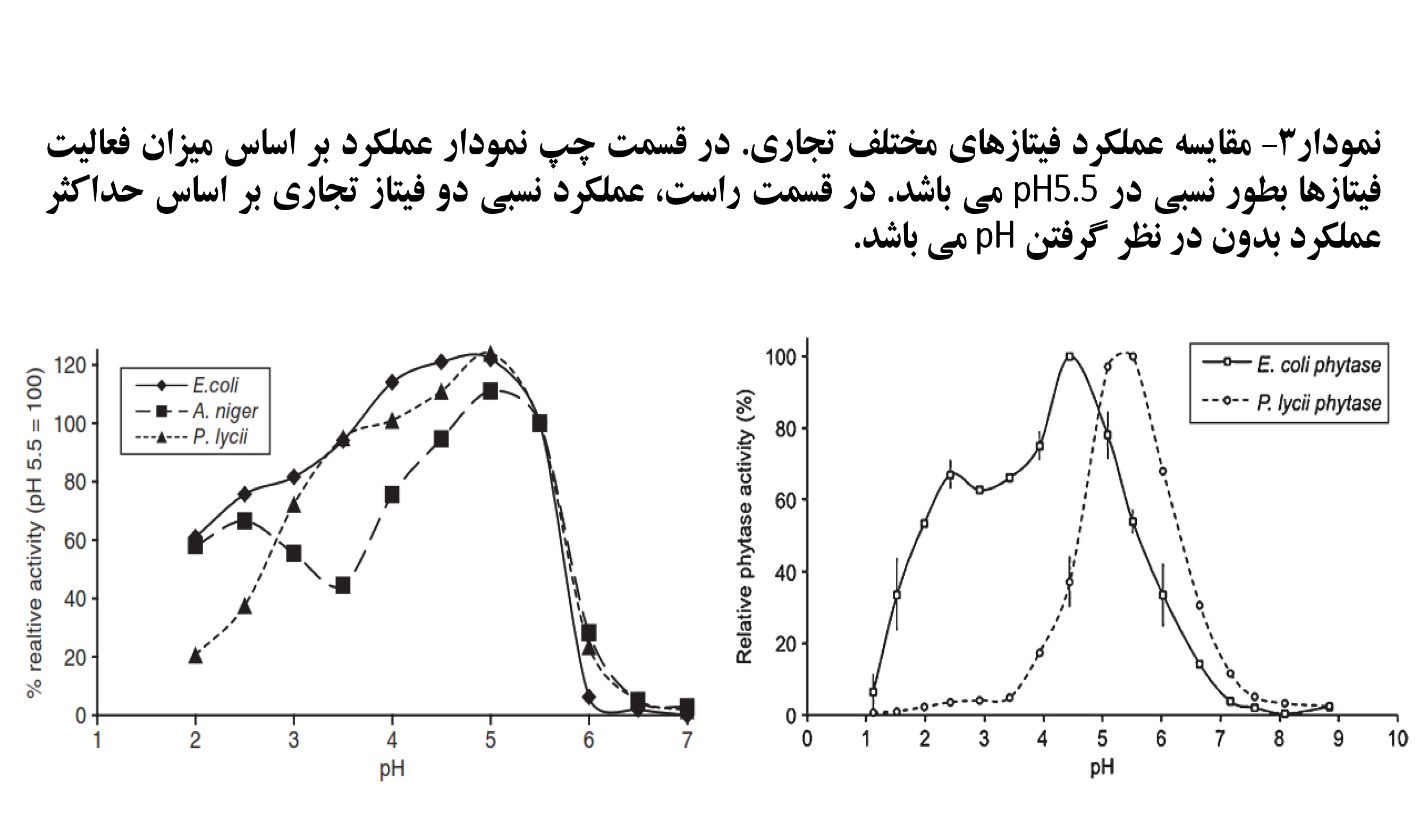
فعالیت نسبی فیتازهای مختلف تجاری در نمودار ۳ که حاصل نتایج به دست آمده در دو آزمایش مجزا می باشد به نمایش گذاشته شده است [۵, ۶]. همان طور که در بخش قبلی توضیح داده شد، فعالیت بهینه آنزیم های فیتاز بایستی در ph های ۲/۵ تا ۴/۵ که ترکیبات فیتاته دارای محلولیت بیشتری هستند باشد تا از نظر زیستی موثرتر باشند [۳]. همان طور که از نتایج نمودار ۳ مشخص است، فیتازهای با منشا باکتری ایکولای دارای فعالیت به مراتب بالاتری نسبت به فیتازهای با منشا قارچی در این دامنه اسیدی می باشند. حتی در بین فیتازهای با منشا ایکولای نیز بر حسب اینکه ژنها در کدام میکروارگانیسم بیان شده باشند، تفاوت فعالیت وجود دارد [۲].
۳- مقاومت فیتازهای مختلف به پروتئازهای درون زادی:
با ورود متخصصین تغذیه به مباحث سنجش آنزیمی که پیشتر تنها توسط متخصصین بیوشیمی انجام می گرفت، نکات بسیار جالبی در این بخش روشن نموده است. شاید همیشه این سوال مطرح بوده که: چرا بین فیتازهای مختلف در شرایط زیستی (مجرای گوارش پرنده) تفاوت کارایی وجود دارد در صورتی که از نظر آزمایشگاهی (لوله آزمایش) میزان فعالیت فیتاز اندازه گیری شده برای فیتازهای متفاوت، مشابه می باشد؟ برای مثال وقتی بیان می شود یک آنزیم فیتاز دارای فعالیت ۱۰ هزار واحد (FTU) یا ۵هزار واحد (FTU) در آزمایشگاه است و با یک غلظت برابر آنزیمی در جیره مورد استفاده قرار می گیرد ،چرا نتایج عملکرد پرنده دارای تفاوت های بارز می گردد[۲]؟
با صرفه نظر از اثرات متقابل جیره بر استفاده از فیتاز (مانند مقادیر فسفر و کلسیم،کیفیت و قابلیت دسترسی منابع تکمیلی، نسبت فسفر به کلسیم، تعادل DCAB جیره، سن و شرایط فیزیولوژیک پرنده و …)، کیفیت فیتاز ها دارای تفاوت های عمده می باشد [۱] اما سوال کاربردی این است که چرا این تفاوت ها در آزمایشگاه با روش های معمول سنجش فعالیت آنزیمی قابل تشخیص نیست؟
برای پاسخ به این سوال بایستی روش استاندارد آزمایشگاهی با شرایط موجود در مجرای گوارشی پرنده مورد مقایسه قرار گیرد. در آزمایشگاه فعالیت آنزیم فیتاز از طریق میزان مولکول های تجزیه شده اسید فیتیک (به شکل فیتات سدیم) در pH=5.5 در دمای ۳۷درجه سنجیده می شود. اما نکته ای که بدان توجه نمی شود این است که در شرایط طبیعی (در خوراک و مجرای گوارشی)، اسید فیتیک به صورت نمک سدیمی و یا آزاد وجود ندارد بلکه به صورت ترکیبات پیچیده ای از فیتات های متصل به پروتئین هستند (شکل ۱) و تاثیر فیتازهای مختلف برای تجزیه این ترکیبات در pH پایین دارای تفاوت های بارزی می باشد. اشکال فضایی فیتات های طبیعی موجود در خوراک و ترکیبات پیچیده فیتات های شکل گرفته در مجرای گوارشی با شکل فضایی فیتات سدیم متفاوت است و بنابراین مقایسه فیتازها در لوله آزمایش نمی تواند معیار مناسبی را در اختیار متخصصین قرار بدهد [۳].
برای مثال در گذشته برتری های عملکرد فیتازهای با منشا ژن اشرشیاکلی نسبت به فیتازهای قارچی تبیین شده بود [۳, ۴] اما با آزمایشات جدیدتر با توجه به نکات فوق، تفاوت های کارایی زیستی بین فیتازهای باکتریایی با هم نیز قابل شناسایی می باشد. هرچند توجه به کیفیت تولید و اعتبار شرکت تولید کننده می تواند همه مباحث علمی موجود در این مقاله را تحت تاثیر قرار دهد.
دستیابی به درک کامل تر از مکانیسم عمل آنزیم فیتاز و ارتباط ماتریکس مواد مغذی [۵] و فرمولاسیون جیره، مدیون بررسی های محققانی مانند Tran و همکاران (۲۰۱۱) است که بر روی کمپلکس پروتئین – اسید فیتیک به عنوان سوبسترا برای فیتاز ، سنجش های کنتیکی انجام دادن [۲, ۳].محققان نشان داده اند که چنانچه از کمپلکس های پروتئین – فیتات به جای فیتات سدیم برای سنجش فیتاز استفاده شود نتیجه آزمایش ارتباط بیشتری با راندمان واقعی فیتازها در بدن پرنده خواهد داشت.
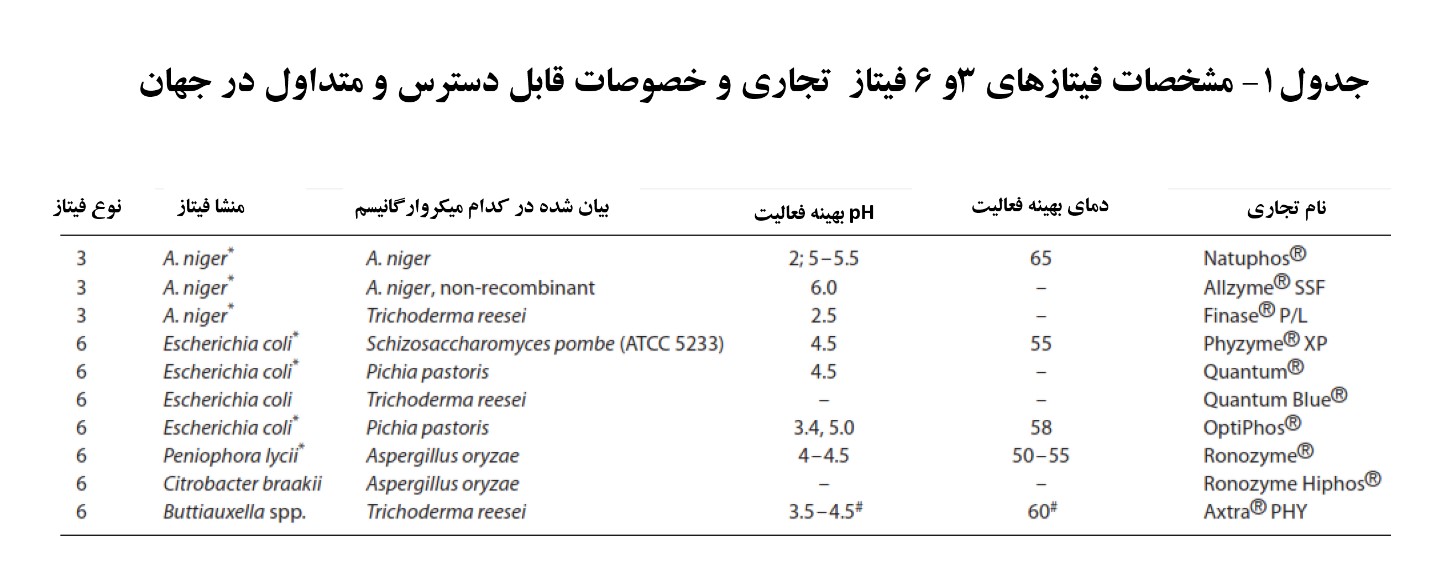
در سنجش های معمول آزمایشگاهی برای کارایی فیتاز، از فیتات سدیم به عنوان سوبسترا ی فیتاز استفاده می شود. ارزیابی ها در مراکز تحقیقی مستقل (غیروابسته به شرکت های تولید کننده فیتاز) بر روی چهار نوع آنزیم فیتاز تجاری متفاوت برای هیدرولیز کردن فیتات سدیم سنتتیک یا کمپلکس های فیتات – پروتئین در خوراک در pH=3 در جدول ۱ نشان داده شده است.
این نتایج نخست تایید می نماید که وقتی فیتات سدیم (IP6-Na) به عنوان سوبسترا در pH=3 مورد استفاده قرار می گیرد مقدار هیدرولیز شدن فیتات سدیم توسط دو نوع فیتاز که از منشا اشرشیاکلی هستند مشابه است اما بطور معنی داری فیتازهای قارچی فعالیت پایینتری دارند. البته تفاوت های بین فیتازهای با منشا ژن اشرشیاکلی و فیتازهای قارچی در آزمایشات گذشته نیز در pH کمتر از ۳ نشان داده شده بود [۴].
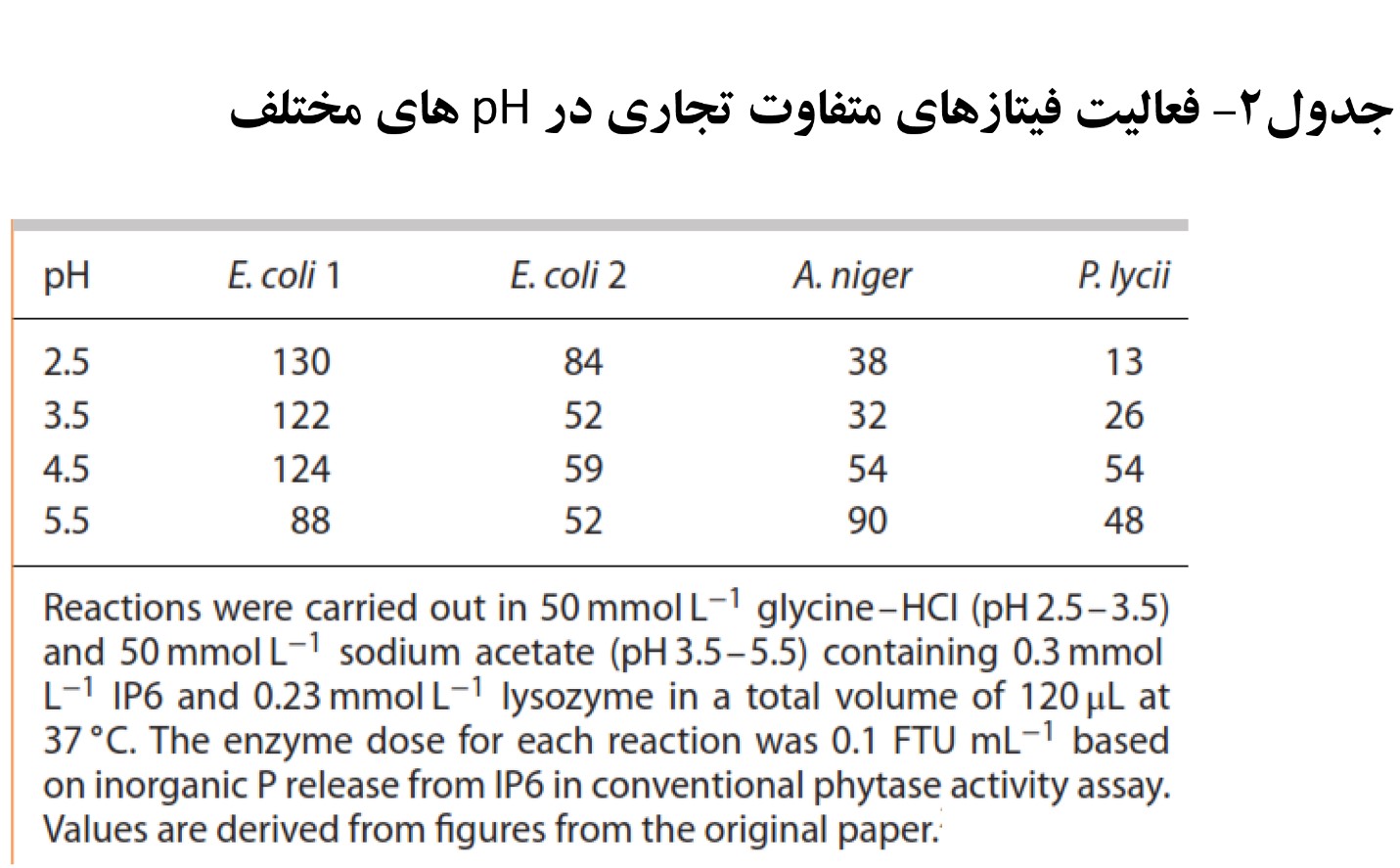
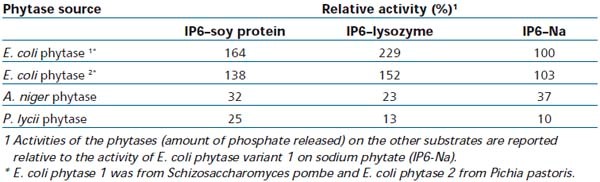
محققان با استفاده از سوبسترای کمپلکس لیزوزیم – فیتات (IP6)، چهار نوع آنزیم فیتاز تجاری (دو فیتاز قارچی و دو فیتاز با منشا اشرشیاکلی) را در pH های ۲ تا ۸/۵ مورد مقایسه قرار دادند. در این آزمایش مشاهده شد که فیتاز واریانت اشرشیاکلی که در ساکارومایسس پومپه بیان شده بود فعالیت بالاتری نسبت به فیتاز اشرشیاکلی بیان شده در پیشاپاستوره در اسیدیته دامنه ۲ تا ۵/۵ داشت. البته فعالیت فیتاز قارچی حاصل از آسپرژیلوس نایجر در اسیدیته ۲/۵ تا ۵/۵ پایین بود [۲]. نتایج این مقایسات در جدول ۲ نمایش داده شده است.
مقاومت فیتازها به پروتئازهای درون زادی در مجرای گوارشی:
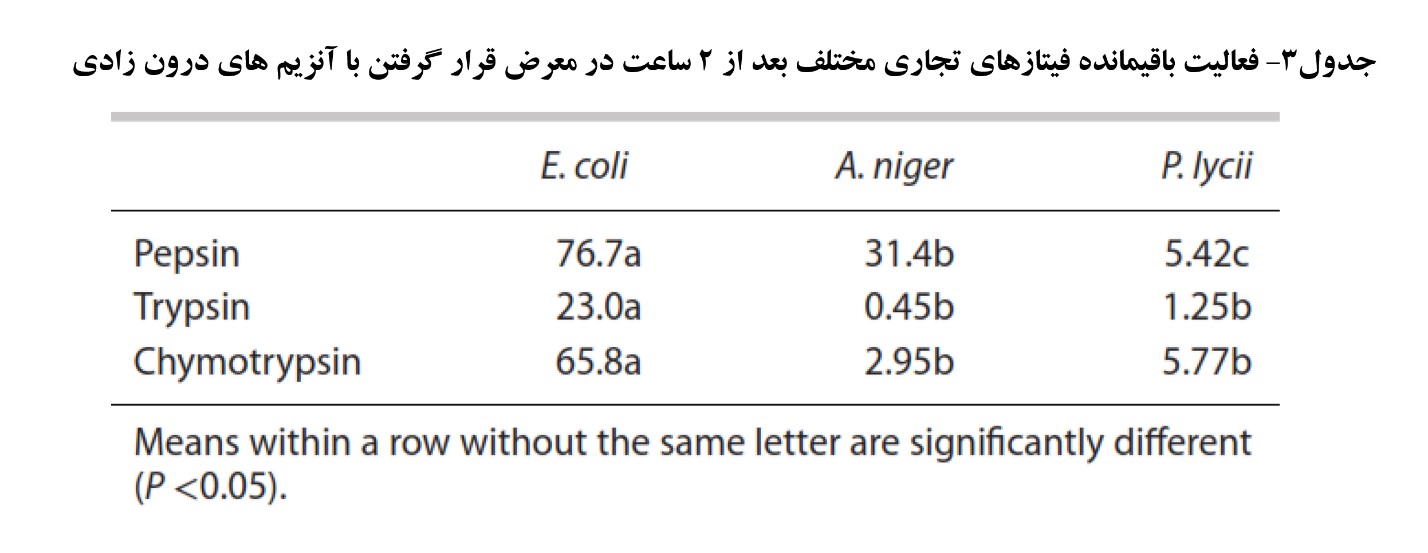
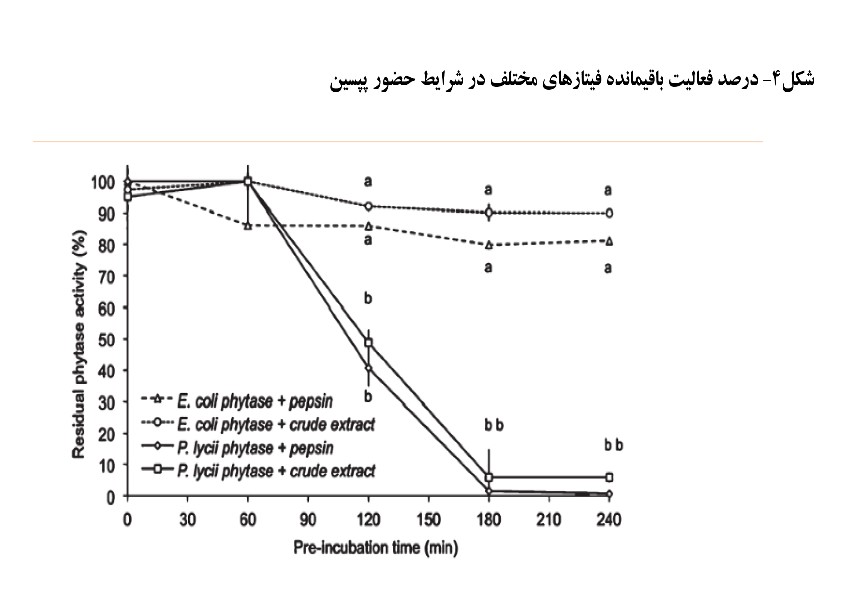
فیتازها مولکول های پروتئینی هستند و بنابراین می توانند توسط پروتئازهای ترشح شده در مجرای گوارشی هیدرولیز و غیرفعال شوند. نتایج تحقیقات کومار و همکاران (۲۰۰۳) که بر روی سه نوع فیتاز قارچی و باکتریایی انجام شده بود نشان داد فیتاز مشتق شده از باکتری اشرشیاکلی مقاومت بالاتری از فیتازهای قارچی در شرایط pH5 و ۲ ساعت در برابر پپسین داشتند (جدول۳). بنابراین این شاخص نیز می تواند در راندمان زیستی فیتازها موثر باشد. البته نتایج مشابهی را مورالس و همکاران (۲۰۱۱) نیز در این ارتباط گزارش نمودند (شکل۴). این نتایج آزمایشگاهی توجیهی برای عملکرد بالاتر فیتازهای ایکولای نسبت به قارچی در طیور و خوک بود.
در همین راستا، ارتباطات قوی تر متخصصین بیوشیمی با متخصصین تغذیه، نه تنها تفاوت های بارزی را بین فیتازهای تجاری (با منشا قارچی و باکتریایی) در توانایی آنها برای تجزیه کمپلکس های فیتات – پروتئین نشان داد بلکه تفاوت های عملکردی بین فیتازهای با منشا ژن اشرشیاکلی که در میکروارگانیسم های متفاوت بیان شده بودند را نیز نشان داد.
اثرات ضد تغذیه ای فیتات به دلیل تشکیل کمپلکس های فیتات – پروتئین در شرایط اسیدی معده رخ می دهد که نتایج تحقیقات در قدم اول مستنداتی قوی را برای خصوصیات مفید استفاده از فیتازها فراهم می نماید و اما ا طرف دیگر این داده ها بیانگر تفاوت های قابل ملاحظه در عملکرد زیستی بین فیتازهای مختلف بودند.
درک جامعی از نتایج این تحقیق که در جدول ۱ مشاهده می شود بسیار اهمیت دارد که نشان می دهد در حالی که هم اکنون در آزمایشگاه از فیتات سدیم به عنوان سوبسترا برای تعیین فعالیت آزمایشگاهی (in vitro) فیتاز استفاده می شود، در حقیقت فیتات در اقلام خوراکی و نیز قسمت های اسیدی مجرای گوارشی (پیش معده و سنگدان) به شکل فیتات سدیم نبوده بلکه اغلب به شکل متصل با پروتئین می باشد.
دلیل این ارتباط بین فیتات و پروتئین در مجرای گوارشی این است که اغلب پروتئین های گیاهی مانند ذرت، کنجاله های سویا، آفتابگردان و کانولا در دامنه اسیدی نقطه pH ایزوالکتریک (PI value) دارند. به همین جهت، وقتی pH در مجرای گوارشی از نقطه ایزوالکتریک پروتئین کمتر می شود پروتئین دارای بار مثبت شده و بدین ترتیب اسید فیتیک که دارای بار منفی است به آن متصل می شود و بنابراین کمپلکس نامحلول فیتات – پروتئین شکل می گیرد (Konietzny and Greiner, 2003).
تشکیل این کمپلکس های فیتات – پروتئین در قسمت اسیدی مجرای گوارشی می تواند عواقب تغذیه ای مهمی دربر داشته باشد که منجر به کاهش عملکرد زیستی پروتئازهای پپسینی شده و در نتیجه موجب افزایش ترشح پپسین و اتلاف بیشتر مواد مغذی درون زادی و هضم ناکارآمد پروتئین می شود که این امر از طریق کاهش قابلیت هضم ایلئومی اسیدهای آمینه به وسیله فیتات در آزمایشات متعدد نشان داده شده است (Vaintraub and Bulmaga, 1991, Konietzny and Greiner, 2003, Kies et al., 2006, Cowieson et al., 2008).
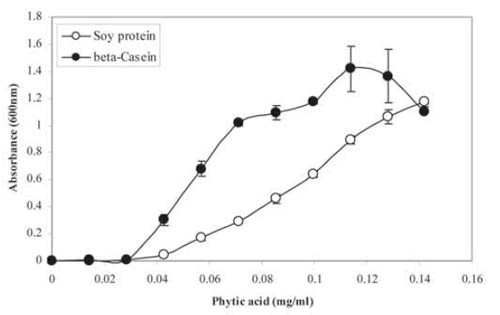
نتایج آزمایشات جدیدتر نشان داده که میزان تشکیل کمپلکس فیتات – پروتئین نامحلول با مقدار فیتات موجود در جیره متناسب می باشد. این نتایج در نمودار ۱ قابل مشاهده است. غلظت کمپلکس های نامحلول فیتات – پروتئین (در هر دو پروتئین با منشا سویا و کازئین)، تقریبا به صورت خطی با افزایش غلظت فیتات افزایش یافته است. از طرف دیگر اثبات شده است که با افزایش سطوح فیتات جیره، اتلاف اسیدهای آمینه درون زادی در پرنده افزایش می یابد. بنابراین فیتات موجب کاهش قابلیت هضم انرژی و اسیدهای آمینه در پرنده میشود. در نتیجه مزایای تغذیهای آنزیم های فیتاز به صورت عمده وابسته به توانایی فیتاز در سرعت تجزیه کمپلکس های
فیتات – پروتئین در pH پایین می باشد و بدین ترتیب با کاهش اثرات ضد تغذیه ای فیتات در بدن پرنده، قابلیت استفاده انرژی و پروتئین بهبود می یابد.
بر اساس نتایج تحقیقات، متخصصین تغذیه به این شناخت رسیده اند که شکل گیری کمپلکس های فیتات – پروتئین در قسمت های اسیدی مجرای گوارشی (پیش معده و سنگدان) مکانیسم اصلی در مورد اثرات ضد تغذیه ای فیتات است و بنابراین استفاده از فیتاز موجب بهبود قابلیت استفاده از اسیدهای آمینه و انرژی می شود و توجه به همین امر می تواند تاثیر به سزایی در انتخاب نوع فیتاز داشته باشد. تفاوت های روشنی بین فیتازهای با منشا های مختلف به وسیله محققان بیان شده است و این تفاوت ها نشان می دهد که مزایای تغذیه ای فیتازهای مختلف نمی تواند مشابه باشد و به بیان دیگر ماتریکس ولیو (matrix value) فیتازهای با منشا مختلف مشابه نیست.
خلاصه و نکات کاربردی:
در چند سال اخیر فیتاز به جزء ثابتی از جیره طیور بدل شده است و این امر موجب کاهش دفع فسفر و صرفه جویی قابل توجهی در مقدار استفاده از منابع معدنی فسفر و بالطبع کاهش هزینه جیره شده است. در نتیجه تحقیقات دهه گذشته بر روی اثرات ضد تغذیه ای فیتات، نشان داده است که این اثرات فراتر از اثر ساده کاهش قابلیت دسترسی کلسیم و فسفر می باشد و اغلب شامل اثرات منفی فیتات در اتصال به پروتئین و اتلاف مواد مغذی دورن زادی (اندژنوسی) و قابلیت استفاده از انرژی و اسیدهای آمینه می باشد.
تجربه کاربرد فیتازهای مختلف در شرایط عملی و فارمی نشان داده است که نمی توان از فیتازهای مختلف عملکرد مشابهی انتظار داشت. نتایج آزمایشات علمی نیز نتایج این مشاهدات را تایید می نمایند.
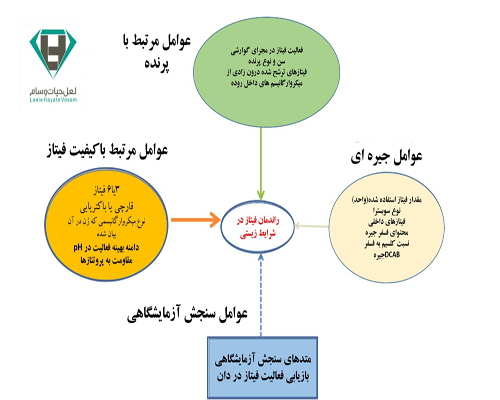
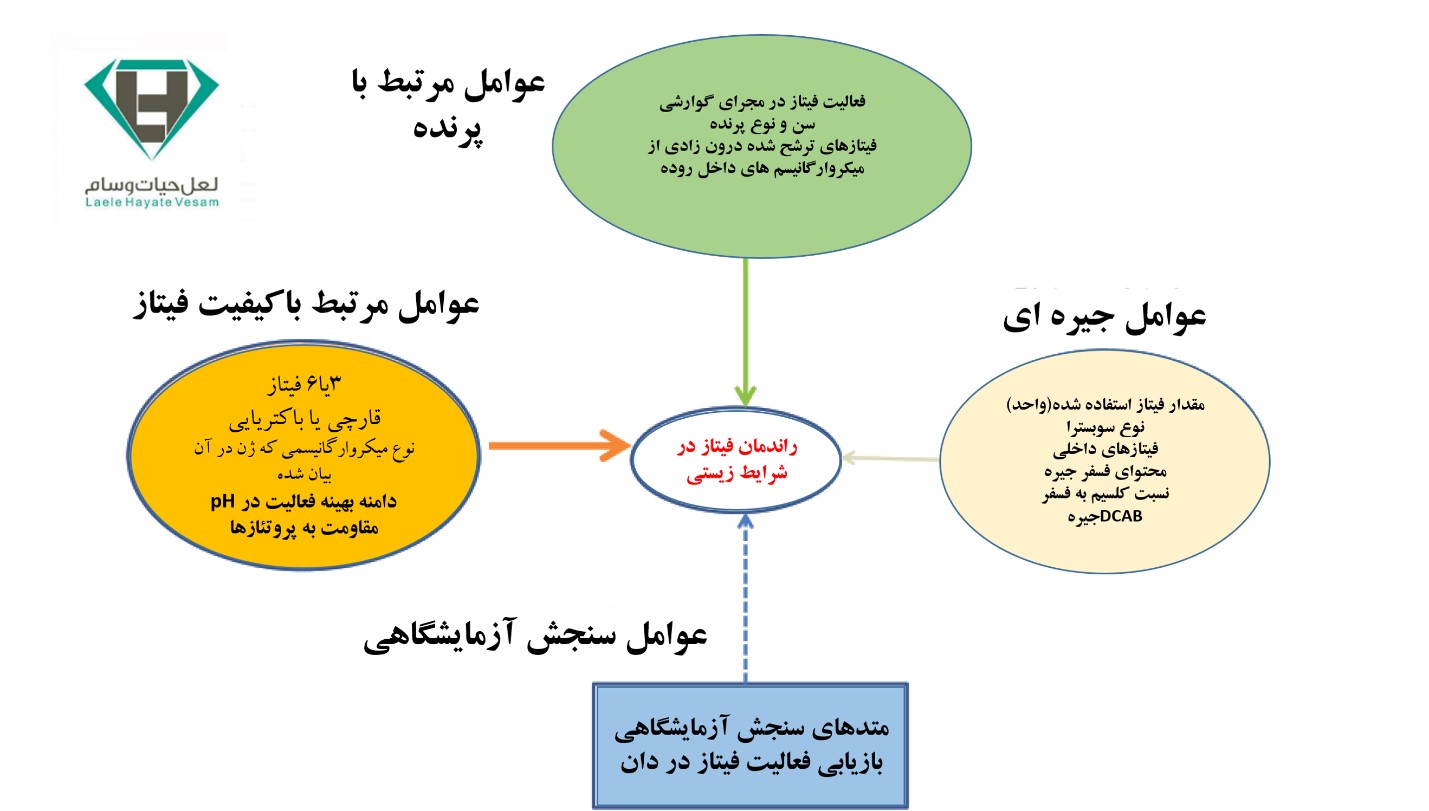
عوامل زیادی می توانند در میزان عملکرد فیتاز در جیره طیور تاثیرگذار باشند.
مهمترین این عوامل عبارتند از:
- اتصال پروتئین به فیتات در pH اسیدی (قسمت های ابتدایی مجرای گوارشی) و تشکیل کمپلکس فیتات – پروتئین،
- منشا فیتاز و توانایی آن در تجزیه کمپلکس های پروتئین – فیتات در pH پایین،
- غلظت فیتات (به عنوان سوبسترای آنزیم) و میزان مصرف آنزیم فیتاز در خوراک
در این بین انتخاب نوع فیتاز ی که بتواند در قسمت های اسیدی مجرای گوارشی کمپلکسهای فیتات – پروتئین را بطور موثری تجزیه نماید نقش کلیدی را دارا می باشد. انتخاب فیتاز.
منابع اصلی مورد استفاده:
.Broch, J., et al., Phytase and phytate interactions on broilers’ diet at 21 days of age. Journal of Applied Poultry Research, 2020. 29(1): p. 240-250
Tran, T.T., et al., A simple and fast kinetic assay for phytases using phytic acid–protein complex as substrate. Analytical biochemistry, 2011. 410(2): p177-184
Dersjant‐Li, Y., et al., Phytase in non‐ruminant animal nutrition: a critical review on phytase activities in the gastrointestinal tract and influencingfactors. Journal of the Science of Food and Agriculture, 2015. 95(5): p. 878-896
Wyss, M., et al., Biochemical characterization of fungal phytases (myo-inositol hexakisphosphate phosphohydrolases): catalytic properties. Appl. Environ. Microbiol., 1999. 65(2): p. 367-373
Morales, A., F.J. Moyano, and L. Marquez, In vitro assessment of the effects of phytate and phytase on nitrogen and phosphorus bioaccessibility within .fish digestive tract. Animal feed science and technology, 2011. 170(3-4): p. 209-221
Kumar, V., et al., In vitro activities of three phytases under different pH and protease challenges. Manipulating Pig Production, 2003: p. 164-164
[۱] 𝛽-propeller phytase
[۲] purple acid phytase
[۳] protein tyrosine phosphatase
[۴] Aspergillus niger
[۵] Matrix Value