ایمن سازهای تغذیه ای، یک استراتژی ویژه در صنعت پرورش طیور
Betwinner Букмекерская Контора Обзор Официального Сайта Бетвиннер, Зеркало
2020/05/29Fnb Customers To Enjoy Another Year Of Two
2020/06/09ایمن سازهای تغذیه ای، یک استراتژی ویژه در صنعت پرورش طیور
Nutritional immunomodulation a special strategy in poultry industry
نویسنده: دکتر فخرالدین عابد، متخصص تغذیه دام و طیور
Fardin.abed@gmail.com
مدیر مارکتینگ و تحقیقات شرکت لعل حیات وسام
بیش از چندین دهه انتخاب ژنتیکی برای شاخص های عملکردی مانند سرعت رشد، موجب به وجود آمدن نژادهای حساس تر به عفونت ها شده است (Huff et al., 2005). به عبارت دیگر، انتخاب برای رشد سریع، به شدت موجب کاهش پاسخ های سیستم ایمنی به چالش های عفونی شده است (van der Most, de Jong, Parmentier, & Verhulst, 2011). سویه های جدید مرغ و بوقلمون با رشد سریع، نسبت به سویه های وحشی و با رشد آهسته دارای سیستم ایمنی اکتسابی ضعیف تر (تولید آنتی بادی)، اما دارای پاسخ های التهابی با واسطه سلولی بیشتر هستند.
این امر می تواند موجب ناکارآمدی سیستم ایمنی در برابر باکتری ای بیماری زا باشد و اغلب تاثیرات نامطلوبی بر روی مصرف خوراک و شاخص های عملکردی می گذارد. (Cheema, Qureshi, & Havenstein, 2003). یکی از بحرانی ترین زمان ها در پرورش طیور، سنین ابتدایی بعد از خروج از تخم است زیرا پرنده هنوز سیستم ایمنی قدرتمندی در برابر عوامل بیماری زا ندارد. نتایج تحقیقات نشان داده که در سنین ۴ تا ۷ روزگی، برخی از اعمال سیستم ایمنی مانند نابودی باکتری ها از روش اکسیداتیو توسط گلوبول های سفید، در نژادهای جدید نسبت به نژادهای وحشی، کاهش قابل ملاحظه ای یافته است. (Genovese, He, Lowry, Swaggerty, & Kogut, 2006).
یکی از فاکتورهای مهم و ضروری برای این که سیستم ایمنی بتواند اعمال خود را به درستی انجام دهد، فراهم نمودن مواد مغذی در سطوح کافی و قابل هضم می باشد. کمبودهای تغذیه ای اثرات منفی بر روی رشد و توسعه اندام های لیمفوئیدی داشته و ساخت مواد فعال ایمنی و تکثیر لمفوسیت ها و فعالیت فاگوسیتی آنها را به طور منفی تحت تاثیر قرار می دهد که در نهایت موجب کاهش مقاومت بدن به عوامل عفونت زا می شود.
مهم ترین مواد مغذی مرتبط با سیستم ایمنی عبارتند از اسیدهای آمینه (آرژنین و متیونین)، ویتامین هایی مانند E، A و C ، عناصر کمیاب (Zn و Se) و اسیدهای چرب با چند پیوند دوگانه (n-3) (Kidd, 2004). بعد از ممنوع شدن آنتی بیوتیک های محرک رشد در اروپا، به دلیل گسترش نگرانی عمومی از مقاومت باکتری های بیماری زا به این دسته از مواد، توجه متخصصین تغذیه به مواد تعدیل کننده سیستم ایمنی مخصوصا در پرنده های پر تولید و یا مواجه با عوامل تنش زا مانند تراکم بالا جلب گردید.
ایمن سازی تعذیه ای:
تعریف اصطلاح ایمن سازی تغذیه ای برای مواد مغذی ویژه یا برخی افزودنی ها بکار می رود که با هدف ایجاد تاثیر در جنبه های خاصی از عملکرد سیستم ایمنی مورد استفاده هستند (Korver, 2012). مکانیسم هایی در سیستم ایمنی حیوان وجود دارند که می توانند ساختارهای شیمیایی عوامل بیماری زا را تشخیص دهند و یک سیگنال اضطراری برای پاسخ ایمنی ایجاد نمایند. بنابراین ایمن سازی تغذیه ای، استفاده از موادی است که حاوی ساختارهای شیمیایی هستند که توانایی فعال نمودن پاسخ های سیستم ایمنی را داراست.
کاربرد مشتقات مخمری به عنوان یک ایمنساز تغذیه ای:
استفاده از مخمر در تغذیه حیوانات به عنوان یک منبع عالی پروتئینی و ویتامین های گروه B در سال های اخیر گسترش زیادی داشته است. تولیدات بر پایه مخمر ساکارومایسس به عنوان محرک رشد و یکی از مناسب ترین مواد ایمن ساز تغذیه ای مورد توجه متخصصین تغذیه و پرورش طیور می باشد (Teng & Kim, 2018).
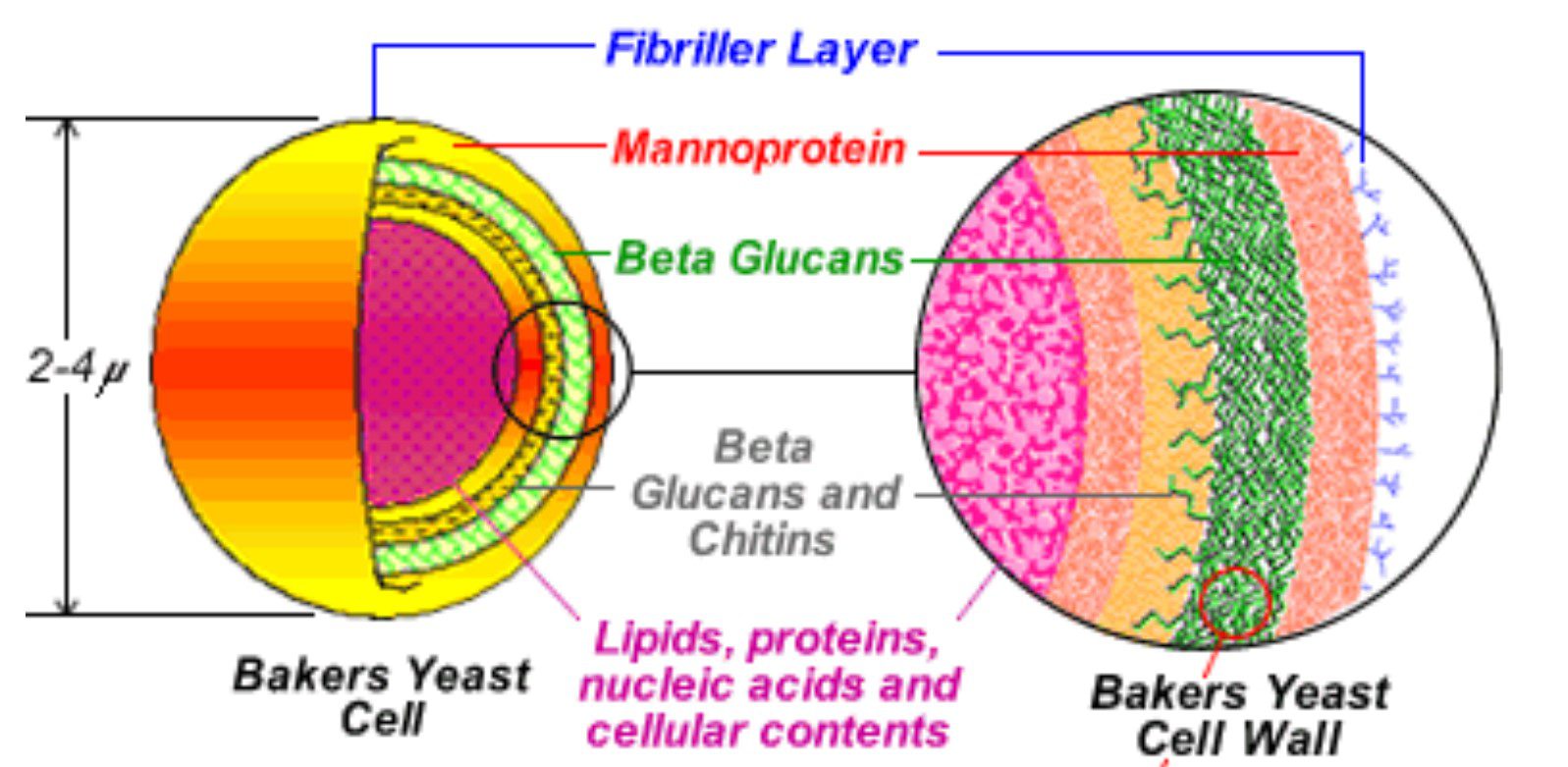
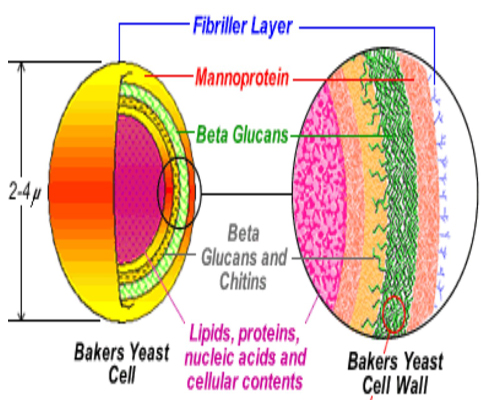
شکل۱: اجزاء تشکیل دهنده یک سلول ساکارومایسیس
مشتقات مخمری از دیواره سلولی آن گرفته تا مواد سیتوپلاسمی که پس از تخلیص دیواره باقی می مانند، هر کدام می توانند با مکانیسم های متفاوتی در مقاومت پرنده به عفونت های باکتریایی، تاثیر داشته باشند. اگر چه ترکیب و محتوای مواد فعال فرآورده های مخمری دارای تنوع می باشد اما آنها معمولا حاوی ترکیباتی با خاصیت تعدیل ایمنی مانند بتاگلوکان با شاخه های ۱ و ۶، مانان الیگو ساکاریدها (MOS) و نوکلئوتیدها، اینوزیتول و گلوتامین هستند.
نکته کاربردی این است که این مواد مغذی و محرک ایمنی تا زمانی که در ساختار یک مخمر دست نخورده حضور دارند مانند مغز گردو در داخل پوسته، قابلیت دسترسی مناسبی ندارند. برای مثال در مورد مزایای تغذیه ای بتاگلوکان به عنوان یک توکسین بایندر، مطالعات زیادی صورت گرفته است اما این ترکیب در قسمت داخلی دیواره سلولی مخمر قرار گرفته و بنابراین قابلیت تماس با سموم قابل جذب توسط این ساختار را ندارد مگر این که این ترکیب از ساختار دیواره مخمر جدا شده و قابلیت تماس با سموم را پیدا نماید.
بتاگلوکان های مشتق شده از دیواره مخمر:
بتاگلوکان ها، پلی ساکاریدهای بلند زنجیر از مونومرهای D گلوکوز با پیوندهای ۱ و ۳ گلوکوزیدی می باشند که حدود ۸۵ درصد دیواره سلولی را تشکیل داده و دارای شاخه های جانبی ۱ و ۶ هستند. ترکیب بتاگلوکان مخمری با بتاگلوکان موجود در ساختار دیواره سلولی غلات متفاوت است زیرا زنجیره جانبی در غلات ۱ و ۴ می باشد.
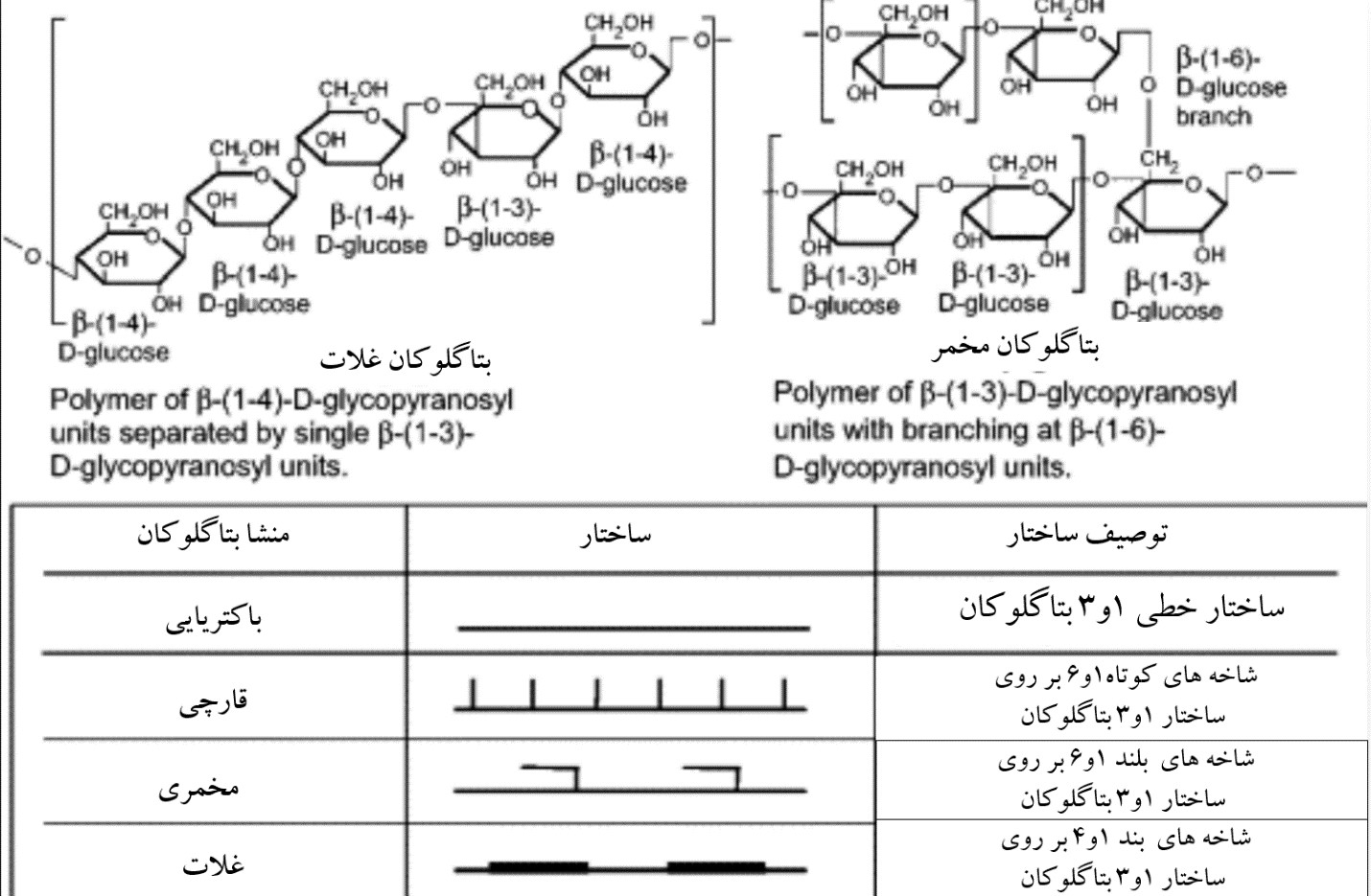
شکل۲: تفاوت های ساختاری بتاگلوکان های با منشا متفاوت مانند مخمری، غلات و باکتری
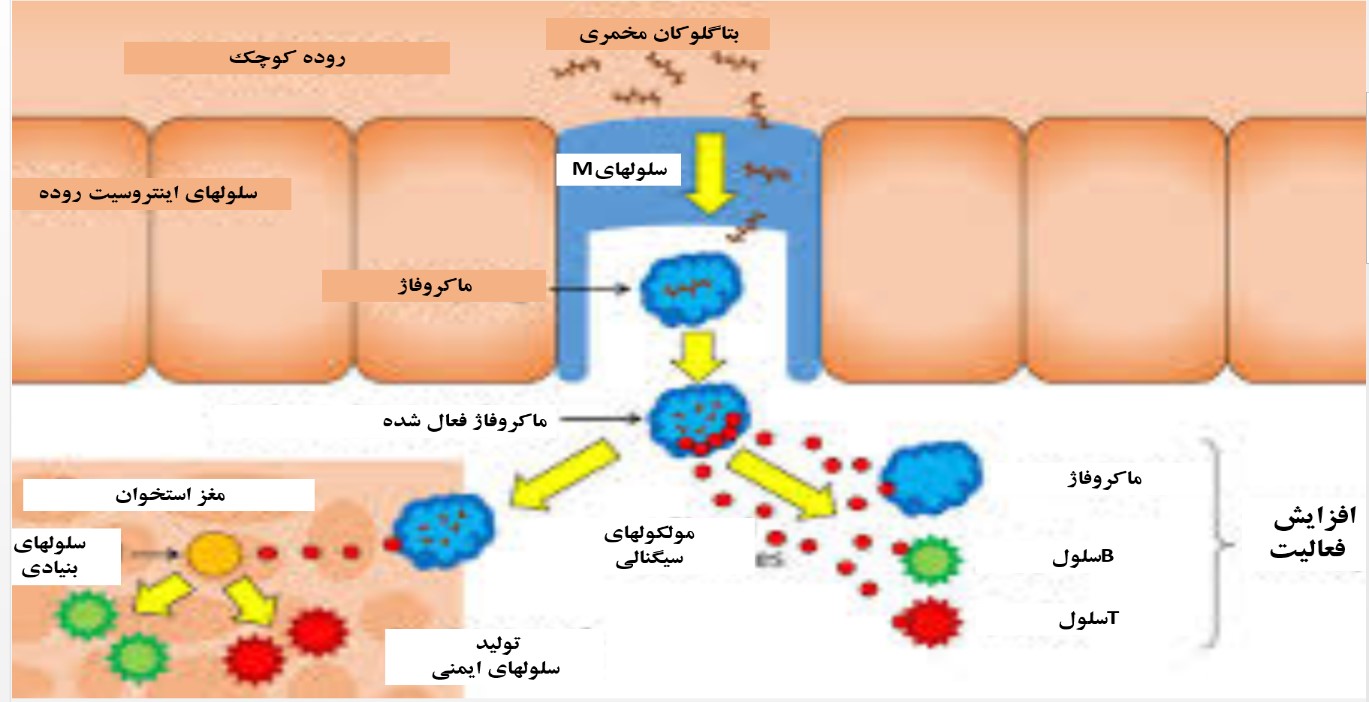
شکل۳: بتاگلوکان ها از طریق سلول های M روده وارد محیط داخلی بدن شده، و موجب تحریک و فعال شدن ماکروفاژها می شوند. ماکروفاژهای فعال نیز از طریق یکسری واکنش های آبشاری موجب تعدیل پاسخ های ایمنی می شوند.
شاخه های ۱ و ۶ در زنجیره بتاگوکان به گیرنده های تشخیصی CR3 ماکروفاژها متصل می شود و منجر به شروع فعالیت آبشاری واکنش ها برای فاگوسیتوز می گردد و تولید سیتوکین ها و آیکوزونوئید هایی مانند اینترلوکین۱ و TNF آلفا و PGE2 را منجر می شود که این امر به تکثیر لمفوسیت های CD4+ و CD8+ می انجامد و موجب افزایش فعالیت سیستم ایمنی ذاتی و اکتسابی می شود (Teng & Kim, 2018). بنابراین وجود هر بتاگلوکان با هر منشایی نمی تواند تاثیر مشابهی بر روی سیستم ایمنی داشته باشد. هر چند تئوری های متعددی برای توضیح مکانیسم تاثیر بتاگلوکان بر سیستم ایمنی ارائه شده است اما به طور کلی، عقیده بر این است که بتاگلوکان ها از سلول های M در پلاک های پیر[۱] جذب شده و در یک مسیر آبشاری موجب فعال شدن ماکروفاژها می شوند که خود به عنوان شروع کننده تحریک سیستم ایمنی می باشد (شکل۳).
بتاگلوکان ها به وسیله گیرنده سلول های سینتینل (Sentinel) شناسایی شده و تولید سیتوکین ها و تکثیر لمفوسیت ها را تحریک می نمایند (Świątkiewicz, Arczewska-Włosek, & Jozefiak, 2014). لمفوسیت ها به سه دسته اصلی تقسیم می شوند. نوع نخست سلول های کشنده طبیعی هستند که نقش مهمی در ایمنی ذاتی دارند. نوع دوم سلول های T هستند که ایمنی اکتسابی را تنظیم نموده و در آخر سلول های B که تولید آنتی بادی ها را علیه آنتیژن ها را بر عهده دارند. همه ی این سه نوع لمفوسیت به وسیله بتاگلوکان تعدیل می گردند.
ماکروفاژها ممکن است یکی از سلول های گیرنده سینتینل باشند که بتاگلوکان ها را تشخیص می دهند. وقتی ماکروفاژها به وسیله بتاگلوکان ها فعال شوند آنزیم نیتریک اکسید سینتاز (iNOS) را تولید می نماید که یک آنزیم تولید کننده مقادیر بالای نیتریک اکسید می باشد. در واکنش آنیون سوپراکسید، نیتریک اکسید، به یک ترکیب رادیکال فعال بسیار سمی دی اکسید نیتروژن تبدیل می شود که توانایی نابود نمودن طیف گسترده ای از باکتری های بیماری زا را به صورت مستقیم دارد و یا موجب توقف ساخت DNA در آنها می شود. همچنین بتاگلوکان موجب تکثیر ماکروفاژها، افزایش توانایی فاگوسیت کنندگی ماکروفاژها و القاءکننده تولید اینترلوکین ۱، اینترلوکین ۱۸ و TNF-α می شود (Cox et al., 2010; Guo, Ali, & Qureshi, 2003).
[۱] Peyer’s patches
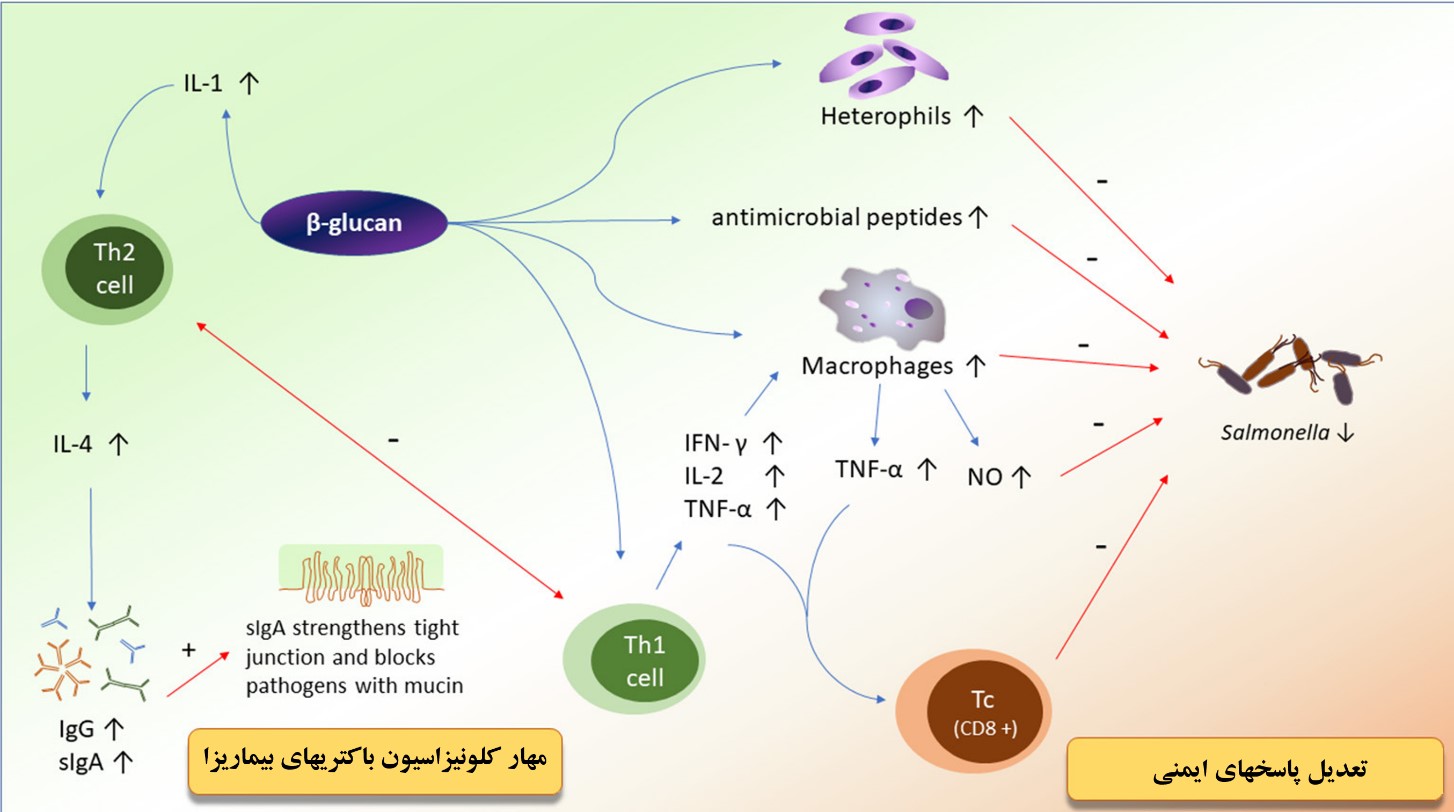
شکل۴: مکانیسم تاثیرگذاری بتاگلوکان مخمری در تحریک سیستم ایمنی و مهار رشد باکتری های بیماری زا
مانان الیگوساکاریدهای دیواره سلولی مخمر با کارایی دوگانه:
اغلب مانان الیگوساکاریدها (MOS) مشتقات دیواره سلولی مخمر ساکارومایسس سرویسیه هستند که غنی از مانوپروتئین، مانان و گلوکان می باشند. مانان الیگو ساکارید مشتق شده از دیواره سلولی مخمر توانایی اتصال و آگلوتینه نمودن باکتری های بیماریزای گرم منفی را که دارای فیبریایی نوع ۱ هستند (سالمونلا و ای-کولای) را دارد(Baurhoo, Ferket, & Zhao, 2009). در زمان مصرف MOS ، لکتین های متصل شونده به دیواره روده در این باکتری های بیماری زا ، به جای متصل شدن به اینتروسیتهای مجرای گوارشی به مانان الیگوساکاریدها متصل می شوند (شکل ۵) و بنابراین از اتصال و کلونیزه شدن آنها جلوگیری می گردد (Spring, Wenk, Dawson, & Newman, 2000).
مقادیر ۰/۰۸ تا ۰/۵ درصد از مانان الیگوساکارید در جیره موجب افزایش جمعیت لاکتوباسیل ها و بیفیدوباکترها و کاهش جمعیت سالمونلا، ایکولای، کلستردیوم پرفیجنس ( عامل آنتریت نکروتیک) و کمپیلوباکتر در قسمت های مختلف روده گردد (Baurhoo, Phillip, & Ruiz-Feria, 2007; Biggs, Parsons, Fahey, & GC, 2007; Corrigan, de Leeuw, Penaud-Frézet, Dimova, & Murphy, 2015; Fernandez, Hinton, & Gils, 2002). مانانالیگوساکاریدها توسط آنزیم های مجرای گوارشی پرنده قابل هضم نیستند و باکتریهای بیماریزا نیز قادر به استفاده از مانانالیگوساکاریدها نمیباشند اما باکتریهای مفیدی مانند بیفیدوباکترها میتوانند از این ماده به عنوان سوبسترا استفاده نموده و جمعیت باکتریهای مطلوب افزایش یافته و بر پایه حذف رقابتی[۱]جمعیت باکتریهای نامطلوب کاهش مییابد.
در زمان مصرف MOS، گونه های لاکتوباسیلوسی در روده بیشتر از سایر گونه های باکتریایی تحت تاثیر مصرف این ماده قرار می گیرند (Corrigan et al., 2015; Corrigan, Horgan, Clipson, & Murphy, 2011). در میان گونه های مختلف لاکتوباسیلی، لاکتوباسیلوس سیرسپتوس[۲] دارای فعالیت ضد میکروبی علیه ایکولای و سالمونلاست در حالیکه لاکتوباسیلوس سالیواروس تنها توانایی محدود کردن رشد سالمونلا را دارد. شاید یکی از دلایل تاثیر MOS در چالش های رودهای همین تاثیر غیرمستقیم از افزایش رشد لاکتوباسیلوسها باشد (Baurhoo et al., 2007).
مصرف MOS در جیره طیور موجب افزایش طول پرزهای روده، سطح جذب مواد مغذی در مجرای گوارشی، کاهش عمق کریپت ها و القاء افزایش تعداد سلولهای گابلت و افزایش بیان ژن موسین می شود (Chee, Iji, Choct, Mikkelsen, & Kocher, 2010; Rajani et al., 2016; Yang, Iji, Kocher, Mikkelsen, & Choct, 2008). مصرف MOS موجب محافظت بیشتر سلولهای گابلت در برابر اثرات تخریبی گلیکوزیدهای باکتریهای بیماریزا میشود. بنابراین سلول های گابلت، حفاظت بیشتری را در برابر باکتری های بیماری زا برای میزبان ایجاد می نمایند.
افزایش سلول های گابلت موجب ترشح بیشتر موسین در روده شده و از طریق به دام انداختن باکتریهای بیماری زا، رشد و اتصال آنها به روده را با محدودیت مواجه مینماید (Belley, Keller, Göttke, Chadee, & Göettke, 1999). همانند بتاگلوکان ها، مانان الیگوساکاریدها نیز می توانند به عنوان یک آنتیژن غیر بیماری زا منجر به تحریک سیستم ایمنی شوند و مشابه با یک ادجوانت فعالیت نمایند. این اثر از مانان الیگوساکاریدها مربوط به حضور گیرنده های مانوزی در سلولهای دفاعی و تشخیص دهنده آنتیژن می باشد (Teng & Kim, 2018).
با استفاده از مصرف MOS، بیان ژن TLR4 و TLR2 در ایلئوم و تانسیلهای سکومی افزایش می یابند. بنابراین می توان نتیجه گرفت که MOS توسط این گیرنده ها قابل شناسایی است. تقریبا همه موجودات زنده مجهز به سیستمهای پیچیده دریافت کننده های علائم محیطی و سیگنالهای زیستی هستند که آنها را تشخیص و با به کارگیری واسطههای داخل سلولی، هماهنگیهای لازم برای پاسخ مناسب را به وجود میآورند. ماهیت این دریافت کنندهها در سیستم ایمنی ذاتی و اکتسابی، از خانواده گیرنده های تاللایک است.
تاللایکها، از اعضاء خانواده بزرگ سیستم گیرندههای تشخیص الگوها هستند که عوامل بیماری زای مهاجم را از طریق دریافت یک سری مولکولهای خاص که در اصطلاح الگوهای مرتبط با عوامل بیماری زا [۳](PAMPs) نامیده میشوند، تشخیص میدهند. الگوهای مرتبط با عوامل بیماری زا شامل ترکیبات متنوعی از عوامل بیماری زا هستند که در میزبان وجود ندارند مانند لیپوپلی ساکاریدها (LPS) و پپتیدوگلیکانهای دیواره سلولی باکتری، فلاژلین (تاژک)، DNA باکتریایی و زنجیرههای RNA دو رشتهای ویروسها.
در حالی که هر کدام از گیرندههای تاللایک به لیگاندهای محدودی پاسخ میدهند، اما در مجموع، خانواده گیرندههای تاللایک میتوانند به طیف گستردهای از مولکولهای مرتبط با باکتریها، ویروسها، قارچها و انگلها پاسخ دهند. تاکنون ۱۰ نوع از گیرندههای تاللایک و لیگاندهای آنها شناسایی شدهاند. نشان داده شده است که تاللایک ۲B مرغ[۴] به عنوان گیرنده لیپوپروتئین عمل میکند و نیز میتواند لیپوپلی سارکارید را در حضور [۵]MD-2 تشخیص دهد. گیرنده تاللایک ۳، مسئول تشخیص RNA دو رشتهای است که با عفونتهای ویروسی مرتبط است.
گیرنده تاللایک ۴، گیرنده اصلی لیپوپلیساکارید است. کمپلکس گیرنده لیپوپلیساکارید شامل گیرنده تاللایک ۴، CD14 وMD-2 میباشد. گیرنده تاللایک ۵ مرغ، فلاژلین (تاژک) را تشخیص میدهد. گیرنده تاللایک ۷، ۸ و ۹ از خانواده گیرنده تال لایک ۷ هستند که اسیدهای نوکئیک داخل سلولی را تشخیص میدهند (Keestra, de Zoete, Bouwman, Vaezirad, & van Putten, 2013). هرچند در خارج سلول، هر گیرنده تاللایک به صورت اختصاصی عمل میکند، اما در داخل سلول همه گیرندههای سیگنال بطورکلی از یک مسیر متداول عمل مینمایند.
اتصال گیرنده تاللایک، با لیگاند مناسب، شروع کننده سیگنالهای اختصاصی متوالی (پشت سرهم) میباشد که سرانجام منجر به فعال شدن عوامل رونویسی و بیان ژنهای پاسخ ایمنی میشود (Schenk & Mueller, 2008). نقش گیرندههای تاللایک در سیستم ایمنی ذاتی بسیار حیاتی و اساسی میباشد.
سلولهای عرضه کننده آنتیژن مانند ماکروفاژها و سلولهای دندریتیک در سطح خود گیرنده های تاللایک را بیان میکنند. عوامل عفونی کننده الگوهای مرتبط با عوامل بیماری زا، به وسیله گیرندههای تاللایک موجود بر روی سلولهای عرضه کننده آنتیژن شناسایی میشوند که مرحله اول تولید سیگنال بوده و در پی آن، یکسری واکنش ها از طریق حد واسطهای نیتروژن و اکسیژن فعال، سیستم ایمنی ذاتی را تحریک میکند.
درضمن، گیرندههای تاللایک، با افزایش تولید مولکولهای تحریک کننده (مانند سیتوکینهای پیش التهابی)، در ایجاد پاسخهای ایمنی اکتسابی نیز نقش دارند. (Keestra, de Zoete, Bouwman, Vaezirad, & van Putten, 2013). گیرندههای تاللایک توسط بافتهای مختلف و انواع سلولها بیان میشوند. هتروفیلهای مرغ، گیرندههای تاللایک ۱، ۲، ۳، ۴، ۵ و ۷ را بیان میکنند. گیرنده تاللایک ۴ نیز، به مقدار زیاد در بافتهای غنی از ماکروفاژ بیان میشوند (Keestra et al., 2013).
مصرف MOS در مرغ موجب افزایش بیان ژن ایلئومی اینترلوکین ۲ و اینترفرون گاما میشود. اینترلوکین ۲، یک سیتوکین است که موجب تحریک سلول های Th1 می شود و اینترفرون گاما موجب تکثیر و سیتوتوکسیتی بیشتر در سلول های ایمنی مانند سلول های T، سلول های کشنده طبیعی و ماکروفاژها می شود (شکل ۶). مصرف MOS همچنین بر پاسخ ایمنی همورال (خونی) اثر می نماید که از طریق عمل نمودن به عنوان یک ادجوانت برای واکسن هاست که موجب افزایش تیتر آنتی بادی می شود.
افزایش تیتر آنتی بادی در برابر واکسن های بیماری های مختلفی مانند گامبرو، نیوکاسل و آنفلونزا در پی مصرف MOS گزارش شده است (Salehimanesh, Mohammadi, & Roostaei‐Ali Mehr, 2016; Shashidhara & Devegowda, 2003; Tohid, Hasan, & Alireza, 2010). البته برخی گزارشات نیز عدم تاثیر قابل توجه در تیتر واکسن ها را نیز در زمان مصرف MOS نشان داده اند و این امر دلالت بر تاثیرات چندعامله مانند تاثیرات محیطی و سایر عوامل بیماری زای حاضر در شرایط آزمایش می نماید (Silva et al., 2009).
[۱] Competitive exclusion
[۲] L.Crispotus
[۳] Pathogen associated molecular patterns
[۴] Chicken Toll-like 2B
[۵] Lymphocyte antigen 96 (also called MD-2)
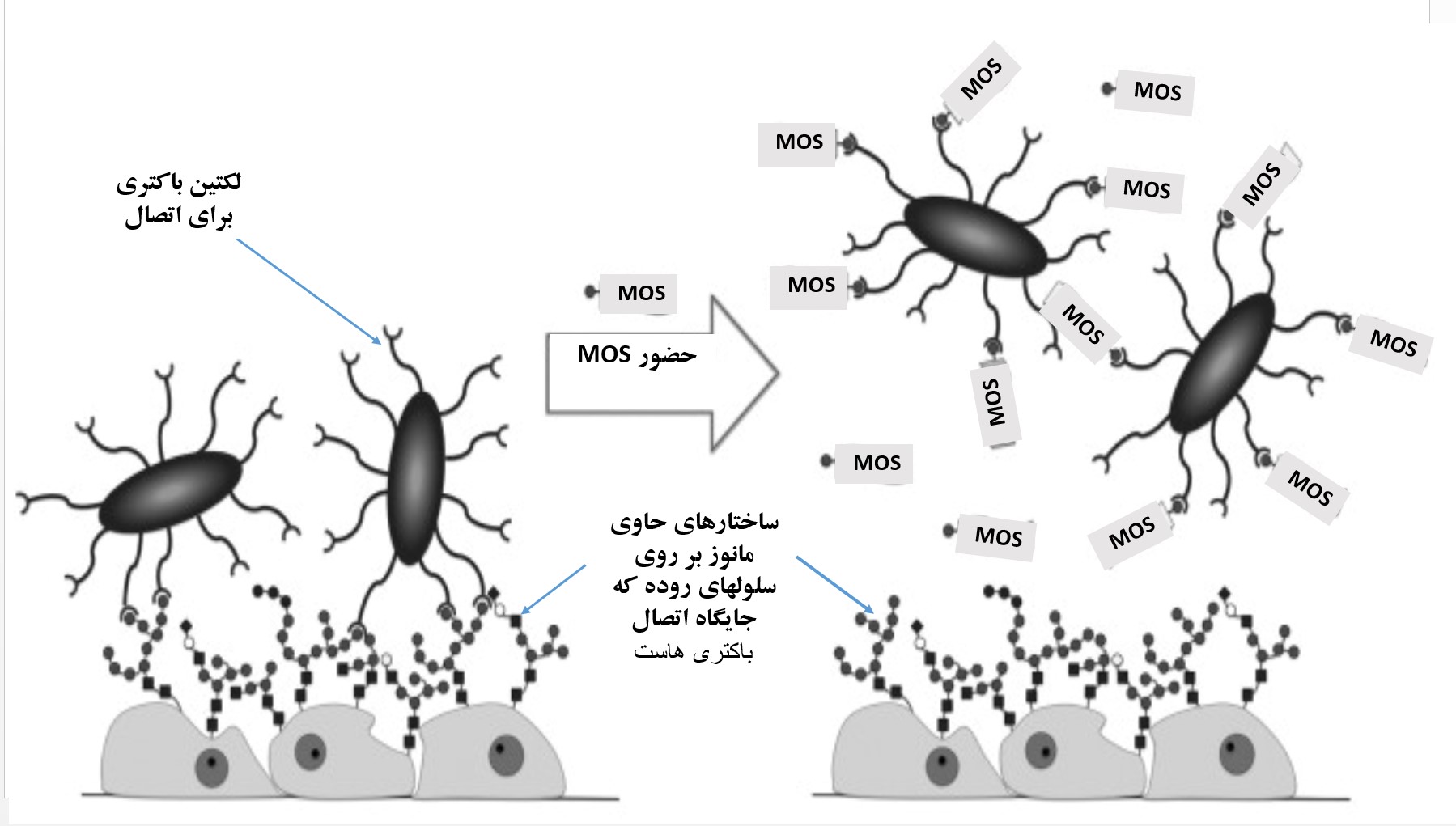
شکل۵- MOS از ساختاری مشابه به مانوز آزاد سطح سلولی اینتروسیت های روده دارد و می تواند به لکتین باکتری های ایکولای و سالمونلا متصل شود از اتصال آنها به روده ممانعت به عمل آورد. مهار رشد باکتری های بیماریزا می شود.
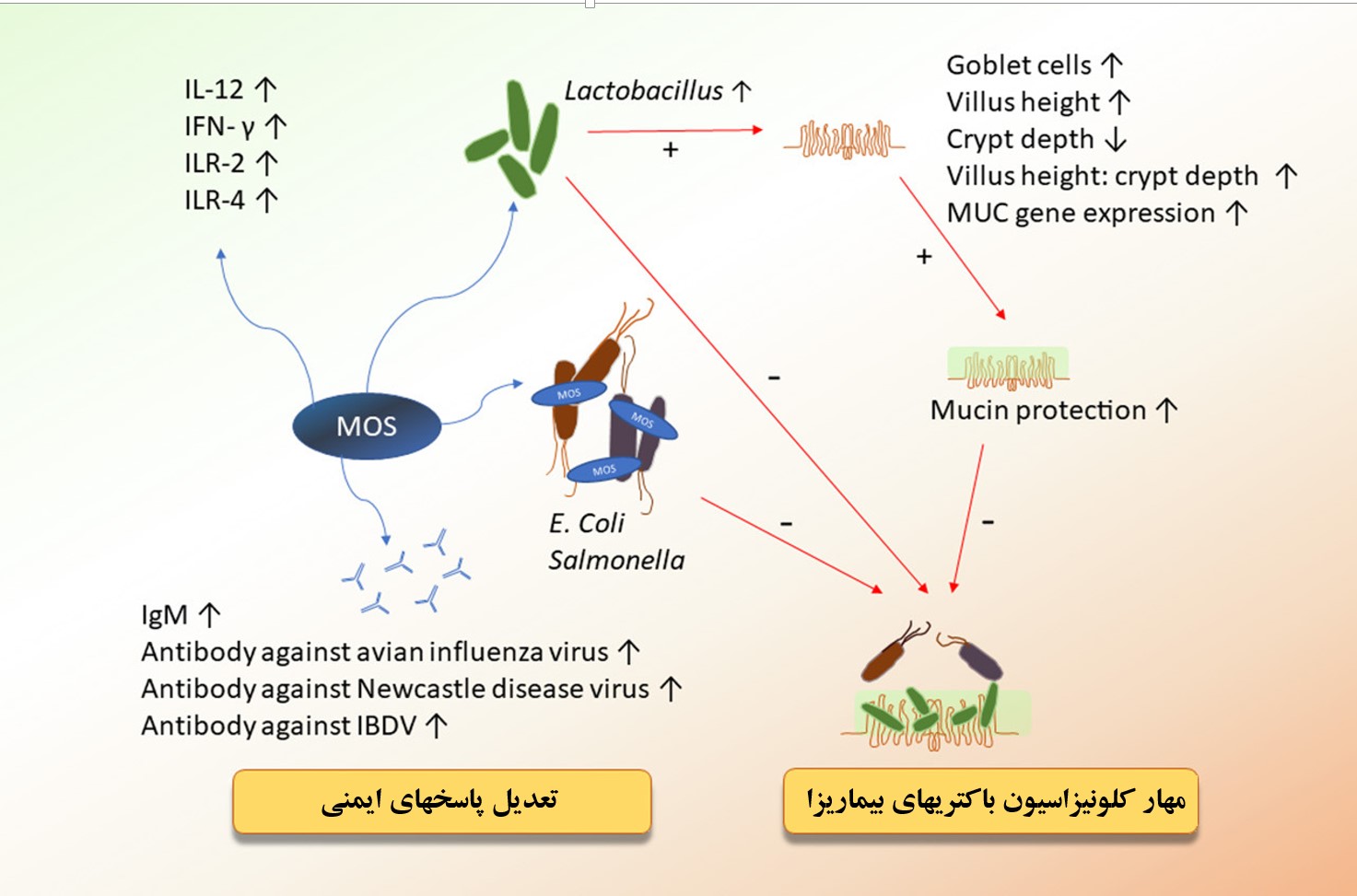
شکل۶- MOS از مکانیسم های متعددی موجب تعدیل سیستم ایمنی و مهار رشد باکتری های بیماری زا می شود.
عصاره مخمری:
پس از جداسازی دیواره سلولی مخمر، باقی مانده آن به عنوان عصاره مخمری خوانده می شود. عصاره مشتق شده از سلول مخمر یک منبع مهم از نوکلئوتیدهاست که از RNA مخمر ناشی می شود و در فرآیندهای متعدد زیستی به عنوان پیش ساز اسیدهای نوکلئیک مورد استفاده قرار می گیرد. اثرات تعدیل ایمنی نوکئوتیدها در پاسخ های ایمنی به عنوان پیش ساز اسیدهای نوکلئیک در آزمایشات invitro و invivo مورد تایید قرار گرفته است.
برای مثال مکمل نمودن جیره موش های آلوده شده با کریپتوسپوریوم با نوکلئوتید موجب افزایش میزان کن کاوالین A و تکثیر سلول های اختصاصی آنتی ژن ها در طحال گردید و تولید IL-2 و اینترفرون گاما را افزایش داد و میزان زنده مانی موش ها در این نوع چالش افزایش یافت و دفع اووسیت نیز کمتر شد. مکانیسم عمل نوکلئوتیدها بر روی سیستم ایمنی هنوز کاملا درک نشده است اما احتمالا می تواند از طریق تامین نوکلئوتید ها برای تکثیر بافت های مربوط به سیستم ایمنی را که نیازمند پیش سازها هستند ارائه اثر نماید.
استفاده از پپتیدهای زیست فعال[۱] نیز اخیرا بسیار مورد توجه تخصصین تغذیه قرار گرفته است. مخمرها حاوی غلظت های بالایی پروتئین هستند که طی مراحل انجام گرفته در طی اتولیز و هیدرولیز پپتیدهای با اندازه کوچک (پپتیدهای زیست فعال) تولید میشوند. این پپتیدها میتوانند منشاء تغییرات متابولیکی متعددی در بدن از جمله تحریک اشتها، خاصیت ضد میکروبی، تحریک سیستم ایمنی و تغییر در ساختار روده باشند (Sharma, Singh, & Rana, 2011; Sugiharto & Ranjitkar, 2018; Wang et al., 2003).
افزودن پپتیدهای با اندازه کوچک میتواند به عنوان محرک ایمنی در حیوان عمل نماید (Wang et al., 2003). پپتیدهای کوچک با خاصیت آنتی اکسیدانی یکی از مکانیسمهای بهبود سیستم ایمنی، مخصوصا در شرایط تنش اکسیداتیو میباشند (Tang et al., 2012). پپتیدهای زیست فعال (Bioactive peptides) عموما دارای ۲ تا ۲۰ اسید آمینه هستند (Singh et al., 2015). پپتیدهای ضدمیکروب (Antimicrobial peptides) طیف خاصی از پپتیدهای زیست فعال هستند که تاثیر بسیار مهمی روی سیستم ایمنی ذاتی میزبان دارند و بر طیف گسترده ای از عوامل بیماریزا از قبیل قارچ ها، باکتریها و ویروس ها موثرند.
پپتیدهای ضد میکروبی را می توان اولین خط دفاعی بدن در مقابل باکتریهای بیماریزا دانست (Zasloff, 2002). تنوع بسیار زیادی در انواع پپتیدهای ضد میکروبی وجود دارد که در این ارتباط بیشترین تمرکز روی پپتیدهای کاتیونیک میباشد (Bechinger & Gorr, 2017). بدلیل اثر متقابلی که این ترکیبات با غشاء باکتری دارند میتوانند از دیواره آنها عبور نمایند و خصوصیات سیتوتوکسیک خود را روی باکتری اعمال نمایند. این ترکیبات نفوذپذیری غشاء باکتری را تحت تاثیر قرار داده و یا موجب عدم تکامل غشاء باکتری میشود (Wimley, 2010). یکی از متداولترین توضیحات برای انتخابی عمل نمودن پپتیدهای ضد میکروبی برای میکروب ها نسبت به سلولهای میزبان، تفاوت در تعامل غشا با توجه به تفاوت های موجود در محتوای لیپیدهای آنیونیک است.
به دلیل سهولت تعاملات الکترواستاتیک، تمایل اتصال پپتیدهای ضد میکروبی به غشاهای میکروبی بسیار زیاد است، در حالی که اتصال آنها به سطوح غنی از غلظت بالای فسفاتیدیل کولین/کلسترول/اسفینگومیلین که در سلولهای جانوری وجود دارد ضعیف است. تاثیر پپتیدهای ضد میکروبی بسیار سریع است. پپتیدهای ضد میکروبی میتوانند گرادیان الکتروشیمیایی را در غشای پلاسمای میکروبی در طی چند ثانیه از بین ببرند.
بنابراین، پپتیدهای ضد میکروبی می توانند از طریق لایه ضخیم پروتئوگلیکانی باکتری های گرم مثبت و لیپوپلی ساکاریدی غشای خارجی باکتری گرم منفی عبور کنند. استفاده از نفوذ نشانگرها در آزمایشگاه، نشان داده است که متابولیتها و پروتئین های سیتوزول، از طریق غشای سیتوپلاسمی در زمان های مختلف از یک دقیقه تا ده دقیقه از باکتری خارج میشوند که نشانه تخریب غشاء آنها میباشد (Wimley, 2010).
خلاصه و نکات کاربردی:
- با توجه به معیار افزایش سرعت رشد در انتخاب ژنتیکی که با توان سیستم ایمنی پرنده نسبت معکوس داشته، امروز ما ناگزیر به پرورش پرنده هایی با سیستم ایمنی به نسبت ضعیف تر هستیم.
- ممنوعیت مصرف آنتی بیوتیک های محرک رشد به عنوان یک ابزار موثر در حفظ سلامت روده، به دلیل ایجاد مقاومت های گسترده میکروبی، توجه متخصصین تغذیه و پرورش طیور تجاری را به سمت جایگزین های آنها جلب نمود.
- ایمن سازی تغذیه ای یکی از استراتژی های موثر در مبحث تغذیه نوین طیور می باشد که از طریق استفاده از مواد مغذی خاص یا افزودنی های غیر آنتی بیوتیکی اجرا می گردد.
- مخمر ساکارومایسس سرویسیه از جمله مواد مغذی ایمن ساز است اگر بتوان مواد مغذی و ایمنی زای آن را قابل دسترس نمود. با استفاده از فرآیند اتولیز و هیدرولیز می توان این مواد را قابل دسترس نمود.
- وجود MOS، بتاگلوکان و پپتیدهای زیست فعال از جمله مهم ترین مواد ایمن ساز در مخمر اتولیز شده می باشند. این مواد با تعدیل سیستم ایمنی و کنترل رشد باکتری های بیماری زا در مجرای گوارشی موجب بهبود راندمان اقتصادی گله های طیور می شوند.
- استفاده از مواد مغذی ایمن ساز در کنار سایر اعمال فنی، تغذیه ای و مدیریتی می تواند میزان وقوع بیماری و تلفات را مخصوصا در شرایط مواجه با عوامل تنش زا که در شرایط پرورش تجاری ناگزیر هستند، کاهش دهند. ایمن ساز های تغذیه ای.
نویسنده: دکتر فخرالدین عابد، متخصص تغذیه دام و طیور
Fardin.abed@gmail.com
مدیر مارکتینگ و تحقیقات شرکت لعل حیات وسام
[۱] Bioactive peptides
منابع مورد استفاده:
Baurhoo, B., Ferket, P., & Zhao, X. (2009). Effects of diets containing different concentrations of mannanoligosaccharide or antibiotics on growth performance, intestinal development, cecal and litter microbial populations, and carcass parameters of broilers. Poultry science, 88(11), 2262-2272
Baurhoo, B., Phillip, L., & Ruiz-Feria, C. (2007). Effects of purified lignin and mannan oligosaccharides on intestinal integrity and microbial populations in the ceca and litter of broiler chickens. Poultry science, 86(6), 1070-1078
Bechinger, B., & Gorr, S.-U. (2017). Antimicrobial peptides: mechanisms of action and resistance. Journal of dental research, 96(3), 254-260
Belley, A., Keller, K., Göttke, M., Chadee, K., & Göettke, M. (1999). Intestinal mucins in colonization and host defense against pathogens. The American journal of tropical medicine and hygiene, 60(4_suppl), 10-15
Biggs, P., Parsons, C., Fahey, & GC. (2007). The effects of several oligosaccharides on growth performance, nutrient digestibilities, and cecal microbial populations in young chicks. Poultry science, 86(11), 2327-2336
Chee, S., Iji, P., Choct, M., Mikkelsen, L., & Kocher, A. (2010). Characterisation and response of intestinal microflora and mucins to manno-oligosaccharide and antibiotic supplementation in broiler chickens. British poultry science, 51(3), 368-380
Cheema, M., Qureshi, M., & Havenstein, G. (2003). A comparison of the immune response of a 2001 commercial broiler with a 1957 randombred broiler strain when fed representative 1957 and 2001 broiler diets. Poultry science, 82(10), 1519-1529
Corrigan, A., de Leeuw, M., Penaud-Frézet, S., Dimova, D., & Murphy, R. (2015). Phylogenetic and functional alterations in bacterial community compositions in broiler ceca as a result of mannan oligosaccharide supplementation. Appl. Environ. Microbiol., 81(10), 3460-3470
Corrigan, A., Horgan, K., Clipson, N., & Murphy, R. (2011). Effect of dietary supplementation with a Saccharomyces cerevisiae mannan oligosaccharide on the bacterial community structure of broiler cecal contents. Appl. Environ. Microbiol., 77(18), 6653-6662
Cox, C., Sumners, L., Kim, S., McElroy, A., Bedford, M., & Dalloul, R. (2010). Immune responses to dietary β-glucan in broiler chicks during an Eimeria challenge. Poultry science, 89(12), 2597-2607
Fernandez, F., Hinton, M., & Gils, B. V. (2002). Dietary mannan-oligosaccharides and their effect on chicken caecal microflora in relation to Salmonella Enteritidis colonization. Avian pathology, 31(1), 49-58
Genovese, K. J., He, H., Lowry, V. K., Swaggerty, C. L., & Kogut, M. H. (2006). Comparison of heterophil functions of modern commercial and wild-type Rio Grande turkeys. Avian pathology, 35(3), 217-223
Guo, Y., Ali, R., & Qureshi, M. (2003). The influence of β‐glucan on immune responses in broiler chicks. Immunopharmacology and immunotoxicology, 25(3), 461-472
Huff, G., Huff, W., Balog, J., Rath, N., Anthony, N., & Nestor, K. (2005). Stress response differences and disease susceptibility reflected by heterophil to lymphocyte ratio in turkeys selected for increased body weight. Poultry science, 84(5), 709-717
Keestra, A. M., de Zoete, M. R., Bouwman, L. I., Vaezirad, M. M., & van Putten, J. P. (2013). Unique features of chicken Toll-like receptors. Developmental & Comparative Immunology, 41(3), 316-323
Kidd, M. (2004). Nutritional modulation of immune function in broilers. Poultry science, 83(4), 650-657
Korver, D. (2012). Implications of changing immune function through nutrition in poultry. Animal Feed Science and Technology, 173(1-2), 54-64
Rajani, J., Dastar, B., Samadi, F., Karimi Torshizi, M., Abdulkhani, A., & Esfandyarpour, S. (2016). Effect of extracted galactoglucomannan oligosaccharides from pine wood (Pinus brutia) on Salmonella Typhimurium colonisation, growth performance and intestinal morphology in broiler chicks. British poultry science, 57(5), 682-692
Salehimanesh, A., Mohammadi, M., & Roostaei‐Ali Mehr, M. (2016). Effect of dietary probiotic, prebiotic and synbiotic supplementation on performance, immune responses, intestinal morphology and bacterial populations in broilers. Journal of animal physiology and animal nutrition, 100(4), 694-700
Schenk, M., & Mueller, C. (2008). The mucosal immune system at the gastrointestinal barrier. Best Practice & Research Clinical Gastroenterology, 22(3), 391-409
Sharma, S., Singh, R., & Rana, S. (2011). Bioactive peptides: a review. Int J Bioautomation, 15(4), 223-250
Shashidhara, R., & Devegowda, G. (2003). Effect of dietary mannan oligosaccharide on broiler breeder production traits and immunity. Poultry science, 82(8), 1319-1325
Silva, V., da Silva, J. D. T., Torres, K., de Faria Filho, D., Hada, F. H., & De Moraes, V. B. (2009). Humoral immune response of broilers fed diets containing yeast extract and prebiotics in the prestarter phase and raised at different temperatures. Journal of Applied Poultry Research, 18(3), 530-540
Singh, B. P., Vij, S., Hati, S., Singh, D., Kumari, P., & Minj, J. (2015). Antimicrobial activity of bioactive peptides derived from fermentation of soy milk by’Lactobacillus plantarum’C2 against common foodborne pathogens. International Journal of Fermented Foods, 4(2), 77
Spring, P., Wenk, C., Dawson, K., & Newman, K. (2000). The effects of dietary mannaoligosaccharides on cecal parameters and the concentrations of enteric bacteria in the ceca of salmonella-challenged broiler chicks. Poultry science, 79(2), 205-211
Sugiharto, S., & Ranjitkar, S. (2018). Recent advances in fermented feeds towards improved broiler chicken performance, gastrointestinal tract microecology and immune responses: A review. Animal Nutrition
Świątkiewicz, S., Arczewska-Włosek, A., & Jozefiak, D. (2014). Immunomodulatory efficacy of yeast cell products in poultry: a current review. World’s Poultry Science Journal, 70(1), 57-68
Tang, J., Sun, H., Yao, X., Wu, Y., Wang, X., & Feng, J. (2012). Effects of replacement of soybean meal by fermented cottonseed meal on growth performance, serum biochemical parameters and immune function of yellow-feathered broilers. Asian-Australasian journal of animal sciences, 25(3), 393
Teng, P.-Y., & Kim, W. K. (2018). Roles of prebiotics in intestinal ecosystem of broilers. Frontiers in veterinary science, 5
Tohid, T., Hasan, G., & Alireza, T. (2010). Efficacy of mannanoligosaccharides and humate on immune response to Avian Influenza (H9) disease vaccination in broiler chickens. Veterinary research communications, 34(8), 709-717
van der Most, P. J., de Jong, B., Parmentier, H. K., & Verhulst, S. (2011). Trade‐off between growth and immune function: a meta‐analysis of selection experiments. Functional Ecology, 25(1), 74-80
Wang, T., Fu, Y., Lv, J., Jiang, H., Li, Y., Chen, C., & Yu, C. (2003). Effects of mini-peptides on the growth performance and the development of small intestines in weaning piglets. Animal Husbandry & Veterinary Medicine, 35(6), 4-7
Wimley, W. C. (2010). Describing the mechanism of antimicrobial peptide action with the interfacial activity model. ACS chemical biology, 5(10), 905-917
Yang, Y., Iji, P., Kocher, A., Mikkelsen, L., & Choct, M. (2008). Effects of mannanoligosaccharide and fructooligosaccharide on the response of broilers to pathogenic Escherichia coli challenge. British poultry science, 49(5), 550-559
Zasloff, M. (2002). Antimicrobial peptides of multicellular organisms. nature, 415(6870), 389